物理定义:熵增过程是一个自发的由有序向无序发展的过程(Bortz, 1986; Roth, 1993)。热力学定义:熵增加,系统的总能量不变,但其中可用部分减少。统计学定义:熵衡量系统的无序性。熵越高的系统就越难精确描述其微观状态。 早在1947年薛定鄂就曾高瞻远瞩地指出了熵增过程也必然体现在生命体系之中(Schrodinger 1947)。人体是一个巨大的化学反应库,生命的代谢过程建立在生物化学反应的基础上。从某种角度来讲,生命的意义就在于具有抵抗自身熵增的能力,即具有熵减的能力。在人体的生命化学活动中,自发和非自发过程同时存在,相互依存,因为熵增的必然性,生命体不断地由有序走回无序,最终不可逆地走向老化死亡。
精选百科
本文由作者推荐
熵增相关的文章
朝圣者是指参加朝圣的人们。朝圣者都是朝着他们认为的天堂方向朝拜的,一般都是庙宇和高山等。朝圣者目的地一般为耶路撒冷、麦加或西藏(分属世界三大宗教基督教、伊斯兰教、佛教)。朝圣者有不同的信仰,他们的朝圣之路都是通往他们内心认为的最神圣的地方。朝圣者在朝圣途中有五步一拜、十步一跪的礼仪。有不少朝圣者,在
炒饭是常见的一种食物,分为多种品类,如扬州炒饭、香肠炒饭、西红柿炒饭、咖喱炒饭、培根炒饭等,很受大众追捧,在各个地方特色化。主要材料是用煮好的米饭、一些菜肴、鸡蛋爆炒而成。一般大众把炒饭当做早饭或者是晚饭,因为炒饭制作方便,耗时较少。
埃德加·爱伦·坡美国小说家、诗人、评论家代表作《黑猫》推理小说的创造者埃德加·爱伦·坡,男,1809年1月19日出生于波士顿,19世纪美国诗人、小说家和文学评论家,美国浪漫主义思潮时期的重要成员,以悬疑、惊悚小说最负盛名。爱伦·坡是美国的短篇小说家先锋之一,并被公认是推理小说的创造者,甚至被视为科幻
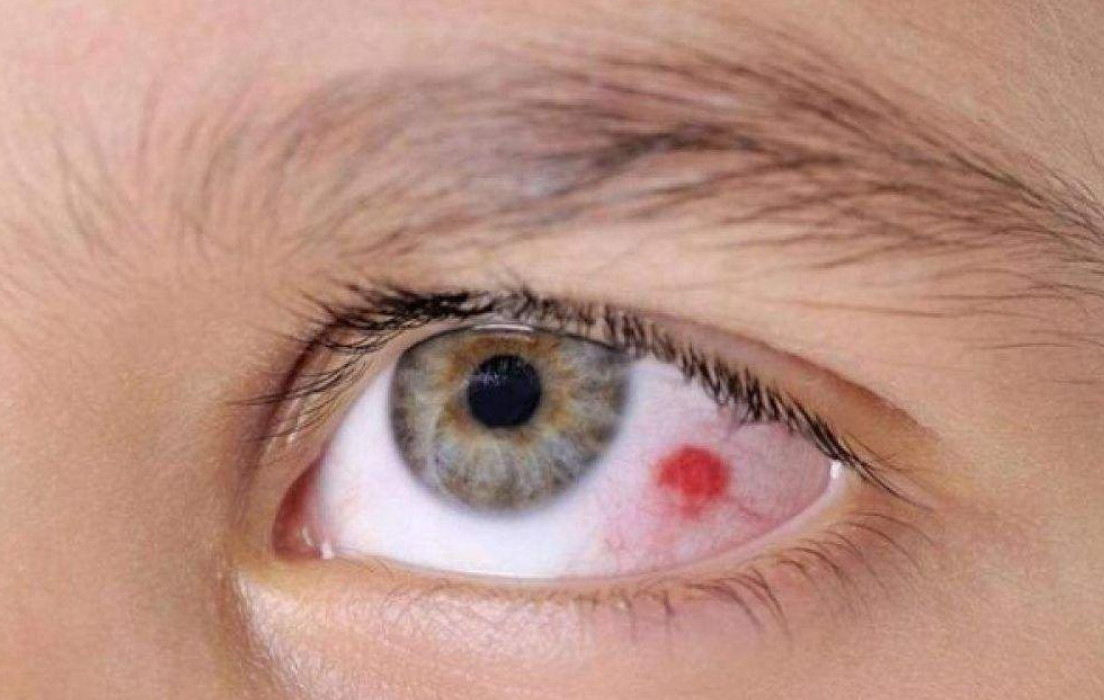
眼底出血是一种由视网膜病变和本身病变而引起的一种疾病。眼底出血不是一种独立的眼病,而是许多眼病和某些全身疾病所共有的特征。全身性血管、血液性病变都可以从视网膜及其血管反应出来,同时也可直接引起视网膜的出血性病变。[1]
常惠(?-公元前46年),西汉大臣,太原郡人。活跃在汉武帝、汉昭帝、汉宣帝三朝的外交活动家。年轻时作为苏武的副使出使匈奴,被扣留十九年。汉昭帝时回国,封为光禄大夫。出使乌孙,击败匈奴,被封为长罗侯。常惠诛杀杀害汉使的龟兹贵人姑翼,之后为典属国。汉宣帝时为右将军。汉元帝时去世,谥号壮武侯。史称“明习外国事,勤劳数有功”。

尚可名片
这家伙太懒了,什么都没写!
作者