解离能就是一分子AB分解成独立的原子A和B所需的能量。是表示化学键强度的物理量。通常把双原子分子中两核间距值为最远时的能量U(∞)与平衡核间距时的能量U(Re)的差值定义为平衡解离能De,即De≡U(∞)—U(Re)。实验上的电子基态解离能D0,是指在所有反应物与产物的电子运动和核运动均处于基态(即0K)时的解离反应的能量改变值。
解离能相关的文章
阿拉伯语(阿拉伯语:لغة عربية ),即阿拉伯人的语言,属于亚洲语系闪米特语族内的西南语支,是中东地区阿拉伯国家联盟22个成员国的官方语言,也是全世界八亿多穆斯林的宗教语言,更是世界诸多国际会议必备的工作语言之一。1974年,阿拉伯语被列为联合国的第六种工作语言。以它为母语的人口达2亿多,全
小编整理:阿沙尔(伊拉克足球运动员)一般指阿德南·阿沙德,1987年10月4日出生于伊拉克,伊拉克职业足球运动员,场上司职前锋,现效力于伊拉克国家队、萨德足球俱乐部。阿沙尔伊拉克足球运动员阿沙尔,男,伊拉克足球运动员。基本信息中文名阿沙尔国籍伊拉克性别男职业信
生产建设兵团是指新中国成立后陆续组建的各类生产建设兵团,是中国通过军垦这种特殊体制达到巩固边防,发展经济,安置人员的目的,兵团成为党、政、军权合一,工、农、兵、学、商五位一体的半军事化组织和社会经济体系,尽管如今只有新疆生产建设兵团存在,但是在那段激情燃烧的岁月里,全国却陆续出现过12个兵团,3个农
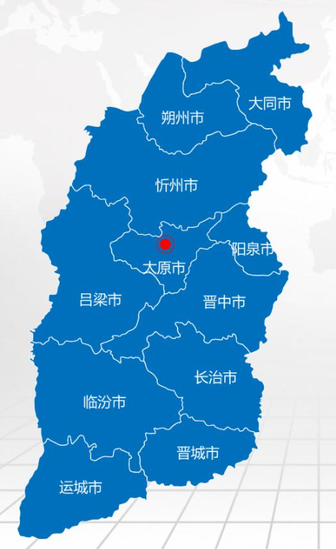
山西本词条是多义词,共3个义项中华人民共和国省级行政区山西,简称“晋”,中华人民共和国省级行政区,省会太原,位于中国华北,东与河北为邻,西与陕西相望,南与河南接壤,北与内蒙古毗连,介于北纬34°34′—40°44′,东经110°14′—114°33′之间,总面积15.67万平方千米。山西省地势呈东北斜向西南的平行四边形,是典型的为黄土覆盖的山地高原,地势东北高西南低。高原内部起伏不平,河谷纵横,地
完颜洪烈是金庸武侠小说《射雕英雄传》中的人物,其历史人物原型是完颜忒邻。完颜忒邻是金章宗完颜璟的六儿子,其母为元妃李师儿,其被封为葛王,早殇。在原著中,在黄蓉的帮助下,完颜洪烈最后被擒拿,被成吉思汗斩首示众。
楼兰,是西域古城遗迹。最早见于《史记》,曾经为丝绸之路必经之地,现只存遗迹,地处新疆巴音郭楞蒙古自治州若羌县北境,罗布泊的西北角、孔雀河道南岸的7公里处。楼兰国是西域古国名,是中国西部的一个古代小国,国都楼兰城(遗址在今中国新疆罗布泊西北岸)。公元前77年楼兰国更名鄯善国,并迁都泥城,向汉朝称臣,原都城楼兰城则由汉朝派兵屯田,西南通且末、精绝、拘弥、于阗,北通车师,西北通焉耆,东当白龙堆,通敦煌,扼丝绸之路的要冲。国人属印欧人种,语言为印欧语系的吐火罗语。由于孔雀河的改道,罗布泊水萎缩,生存环境日益恶劣,

尚可名片
这家伙太懒了,什么都没写!