三元弱碱,即一分子该物质含有三分子氢氧根的弱碱,但是无法完全电离,电离能力极弱。如:Fe(OH)3。
三元弱碱相关的文章
脑炎是指脑实质受病原体侵袭导致的炎症性病变。绝大数的病因是病毒,也可由细菌、霉菌、螺旋体、立克次氏体、寄生虫等感染引起。脑炎的发病多因机体抵抗力下降,病原菌趁机通过呼吸道,消化道,性传播和密切接触等各种形式,经过血循环,透过血-脑屏障进入到大脑,或是脑组织邻近部位感染直接侵犯脑组织,从而引起脑炎的发
公孙止是金庸武侠小说《神雕侠侣》中的反派人物,绝情谷谷主,武功直追“天下五绝”。他是「铁掌莲花」裘千尺之夫,家传武功有闭穴功、「阴阳倒乱刃法」和「鱼网阵」,又从妻子处学来铁掌功,武功直追金轮法王,裘千仞等人。公孙止为争夺小龙女,曾与杨过三度交锋,第三战因裘千尺从旁指点杨过而落败,闭穴功被破,更因中了
塔克拉玛干沙漠(含义:“胡杨树之乡”、“多胡杨树的地方”),别称“死亡之海”,位于中国新疆塔里木盆地的中央,东面有祁连山,西面是阿赖山与塔吉克斯坦共和国接壤,南面是昆仑山,北面是天山。塔克拉玛干沙漠分属于新疆维吾尔自治区巴音郭楞蒙古自治洲、喀什市、和田市和阿克苏地区。塔克拉玛干沙漠是中国最大的沙漠,
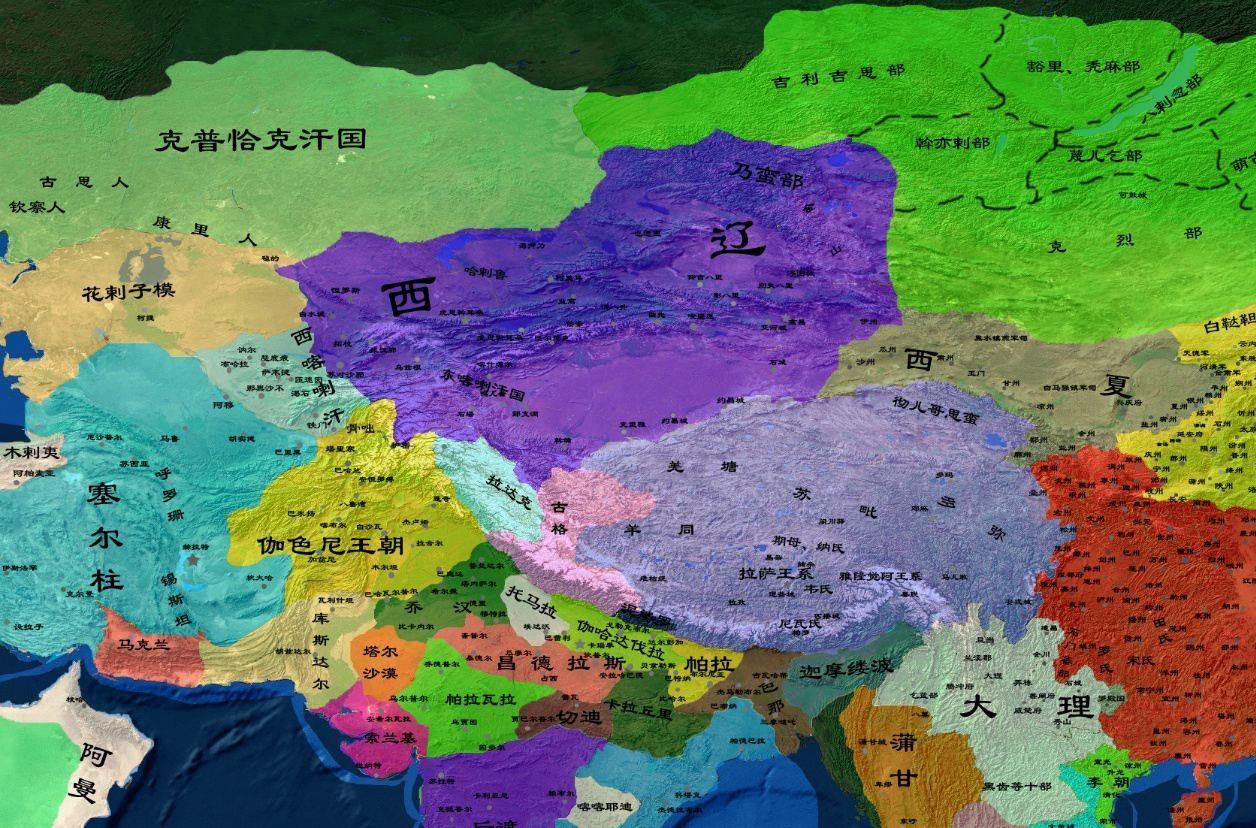
西辽(1124年~1218年)是中国历史上由契丹族在中国新疆和中亚地区建立的政权,历三世三帝二后,享国八十八年。西辽的建立者耶律大石是辽朝开国皇帝耶律阿保机的八世孙。耶律大石原本效力于天祚帝,在辽朝即将灭亡之际出奔。1124年,耶律大石称王,到达可敦城(今蒙古国布尔干省青托罗盖古回鹘城)建立根据地。1132年,耶律大石在叶密立城登基称帝,号“菊儿汗”,群臣又尊汉号为“天祐皇帝”,建元延庆,西辽正式建立。随后耶律大石向西域、漠北、中亚等地区扩张,建都于虎思斡鲁朵(今吉尔吉斯斯坦托克玛克东南布拉纳)。在114
路易斯,美国物理化学家。从他的电子理论出发,他还为酸碱作出了更为广泛的定义:可接受一个电子对的物质是酸,可给出一个电子对的物质是碱,形成路易斯酸碱理论。常见的路易斯酸有氯化铝、氯化铁、三氟化硼、五氯化铌以及镧系元素的三氟甲磺酸盐。路易斯酸,又称亲电子试剂,指可以接受电子对的物质,这是根据路易斯的酸碱电子理论对酸的定义确定的。由于它所包含的物质极为广泛,也称广义酸。

尚可名片
这家伙太懒了,什么都没写!