热化学数据(thermochemical data)是指与物理和化学变化的热效应有关的基础数据。
精选百科
本文由作者推荐
热化学数据相关的文章
亨利八世(公元1491年6月28日—1547年1月28日,英文:Henry Ⅷ),都铎王朝第二位英格兰国王,首位爱尔兰国王,英格兰国王亨利七世与伊丽莎白王后的次子,英国王储亚瑟的弟弟。
伯父是汉语中对父亲的哥哥的称呼,也可以指大伯子,即丈夫的哥哥。在英文中,伯父与叔父、舅父等统称为Uncle。伯父妻子则称为「伯姆」、「伯娘」或「伯母」。此外,「伯父」、「伯伯」、「阿伯」也可以作为对比自己父亲年纪大的男性长辈的尊称,如「世伯」。同时,「伯伯」、「阿伯」也是对一般中老年男性的称呼。
克孜勒苏柯尔克孜自治州(维吾尔文:قىزىلسۇ قىرغىز ئاپتونوم ئوبلاستى;柯尔克孜语:كىزىلسۋ كىزگىز اۆتونومييالى وبلاستى ),是中国新疆维吾尔自治区下辖自治州,位于新疆维吾尔自治区西南部,与吉尔吉斯斯坦、塔吉克斯坦两国接壤,边境线长117
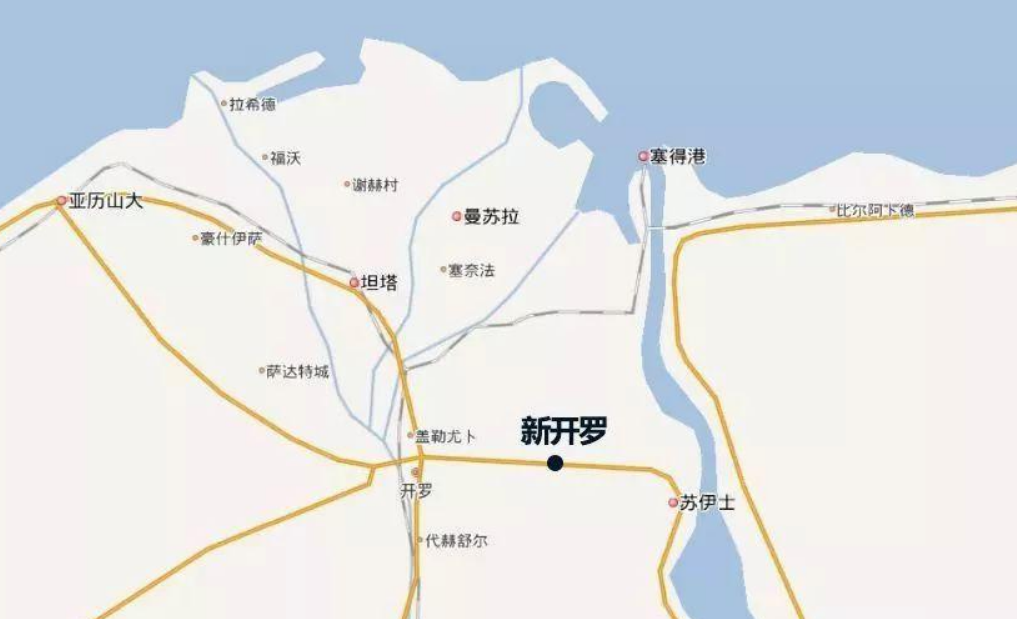
新开罗”将是一个人为创造出来的首都,可能与现在的埃及格格不入,却符合政治精英们对埃及未来的幻想。计划中的“新开罗”将是一个美丽的地方,一个“创新中心”,具有可持续发展的环境,城市居民享有高质量的生活,人们在这里可以自由呼吸,而不会因沙尘暴咳嗽不已。与之相比,“老开罗”是一个丑陋的城市。从机场到市区,一路上的建筑物都被污染物弄得脏兮兮的。耳朵里充斥着刺耳的汽车笛声,一到冬天,尼罗河上就笼罩着一层浓雾。街道上总是塞满了汽车,它们就像是这座城市的动脉血栓一样。当然,尼罗河畔会有些时尚女士穿着高跟鞋踱步,让这个城

尚可名片
这家伙太懒了,什么都没写!
作者