定义
镧系元素(lanthanide element)质地比较软,具有延展性,活泼性很强。所有镧系元素既能生成化学性质类似的三价化合物,个别镧系元素也能生成比较稳定或不很稳定的四价或二价化合物,所以15个元素的化学性质并不完全相似,在光学、电磁学等物理性质也有较大的差别。
由于镧系元素都是金属,所以又称镧系金属。镧系元包括镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥,它们都是稀土元素的成员。镧系元素用符号Ln表示。镧系元素和锕系元素统称为f区金属。
镧系金属
来源
前四种锕系元素锕、钍、镤、铀存在于自然界。镎至铹11种锕系元素则全部用人工核反应合成(镎、钚在含铀矿物中也有发现,但其量极微),合成的方式有在反应堆或核爆炸中辐照重元素靶及在加速器上用带电粒子轰击重元素靶等。
丰度稀土元素并不稀少,但在地壳中分布分散,彼此性质相似,难以提取、分离。原子序数为偶数的元素一般比相邻原子序数为奇数的的元素的含量高。
矿藏按其存在形态,主要有三种类型的矿源:
1.稀土共生构成独立的稀土元素矿物。
2.以类质同晶的形式分散在方解石、磷灰石等矿物中。
3.吸附状态存在于粘土矿、云母矿等矿物中。
我国稀土——储量大、分布广、矿种齐全、易开采。南方以重稀土为主,内蒙古以轻稀土为主。
具有重要工业意义的稀土矿物有磷钇矿(YPO4)、氟碳铈矿(Ce(CO3)F)、褐钇铌矿(YNbO4)等。
分组根据稀土元素性质的递变情况将稀土元素分组有以下几种情况:
从原子的电子层构型以及它们的原子量的大小把稀土元素分成两组:即铕以前的镧系元素叫做轻稀土元素或称铈组元素;把铕以后的镧系元素加上钇叫做重稀土元素或称钇组元素。
按照稀土元素硫酸盐溶液与Na2SO4等生成的稀土元素硫酸复盐在水溶液中的溶解度可把稀土元素分为三组:即镧到钐的硫酸复盐难溶,称为铈组;铕到镝的硫酸复盐微溶,称为铽组;钇及钬到镥的硫酸复盐易溶,称为钇组。也有人把铽组称为中稀土元素。

镧系金属
电子吸收光谱
特点
1.大多数Ln离子在可见光区内有吸收。
2.具有相同未成对f电子的稀土离子具有相近的颜色。
3.Ln离子是由f-f跃迁产生的。f-f跃迁属于禁阻跃迁,其吸收光谱的摩尔消光系数很小(约为0.51·mol·cm)。
4.其吸收光谱为类原子的线状光谱
5.也可以发生Ln配体间的电荷迁移光谱,这时摩尔消光系数较大(约为50~1000l·mol·cm)
离子的磁性
镧系元素的磁性较复杂,镧系元素由于4f电子能被5s和5p电子很好的屏蔽掉,受外电场的作用较小,轨道运动对磁矩的贡献并没有对周围配位原子的电场作用所抑制,所以在计算其磁矩时必须同时考虑电子自旋和轨道运动两方面对磁矩的影响。
镧系元素及化合物中未成对电子数多,加上电子轨道运动对磁矩所作的贡献,使得它们具有很好的磁性,可做良好的磁性材料,稀土合金还可做永磁材料。
应用
应用领域镧系元素应用极为广泛。化学工业上主要用作催化剂。例如混合镧系元素的氯化物和磷酸盐用作催化剂,以加速石油的裂化分解。混合稀土氧化物广泛用作玻璃抛光材料和玻璃的脱色剂,还可用来制造耐辐射玻璃和激光玻璃。用三氧化二钇和三氧化二镝可制得耐高温透明陶瓷,这种陶瓷被用于火箭、激光、电真空等技术工程上。此外,电视工业中大量使用的荧光粉为某些稀土化合物,此荧光粉用于制造电视荧光屏。
钢铁中加入少量稀土元素,可大大改善钢的机械性能,因此稀土元素可称为钢铁的“维生素”。例如在生铁里加进铈,可得到球墨铸铁,使生铁具有韧性且耐磨,可以铁代钢,以铸代锻。
此外,农业上用稀土元素可使粮食增产10%~20%,白菜增产29%,大豆增产50%,还可提高西瓜的产量和甜度,因此用作高效微量肥料。

镧系金属
氧化态镧系元素在固态、水溶液中或其他溶剂中的特征氧化态是+3。由于镧系元素在气态时,失去两个6s电子和一个5d电子或失去两个6s电子和一个4f电子所需的电离能比较低,所以一般能形成稳定的+3氧化态。除+3特征氧化态外,镧系元素还存在着一些不常见的氧化态。例如:铈、镨、钕、铽、镝存在+4氧化态,原因是它们的4f层保持或接近全空、半满或全充满的状态比较稳定,但只有+4氧化态的铈能存在于溶液中,它是很强的氧化剂。
同理,铈、钕、钐、铕、铥、镱还存在+2氧化态。
物理性质
镧系金属具有银白色或灰色光泽,质地比较软,具有延展性并具有顺磁性。镧系金属的活泼性很强,其活泼性仅次于碱金属和碱土金属,比Al和Zn都强。由于镧系金属性质活泼,所以在空气中能与O2反应生成氧化物。在高温时,镧系金属可与卤素、N2、C、S等非金属反应,生成相应的卤化物、氮化物、碳化物和硫化物。Ln金属随原子序数的增大而金属活泼性稍有减弱,但它们都是很强的还原剂。
标准电极电位表明,镧系金属元素的j°(Ln3+/Ln)随原子序数的增大而逐渐减小,但都低于-1.99V,足见其金属活泼性之强。镧系金属能与H2O反应,尤其是与热水反应较剧烈,同时放出H2。如果与稀酸反应,则更易放出H2。由j°(Ln3+/Ln)数据还可看出,Ln中Eu和Yb的一些性质与其它成员相比显得较为突出。正如它们的原子半径在这两个元素出现两个峰值一样,Eu和Yb的j°(Ln3+/Ln)和(I1+I2+I3)也与整个变化趋势不一致,也呈两个相对较高的值;而密度和熔点则突出地较低。如果用这些数据对原子序数作图,则在Eu和Yb处将出现两个峰值或谷值。这一现象应与Eu和Yb分别具有4f76s2和4f146s2的稳定夹层电子构型有关。
化学性质
镧系金属是强还原剂,其还原能力仅次于Mg,其反应性可与铝比。而且随着原子序数的增加,还原能力呈逐渐减弱的趋势。
在酸性溶液中Ln离子为强还原剂,Ln离子为强氧化剂。
由于镧系和锕系两个系列的元素随着原子序数的增加都只在内层轨道(相应的4f和5f轨道)充填电子,其外层轨道(相应的6s、5d和7s、6d轨道)的电子排布基本相同,因此镧系元素和锕系元素不仅化学性质相似,而且每个系列内元素之间的化学性质也是相近的。大多数锕系元素都有以下性质:能形成络离子和有机螯合物的三价阳离子;生成三价的不溶性化合物,如氢氧化物、氟化物、碳酸盐和草酸盐等;生成三价的可溶性化合物,如硫酸盐、硝酸盐、高氯酸盐和某些卤化物等。在水溶液中多数锕系元素为+3氧化态,前面几个和最后几个锕系元素还有不同的氧化态,如镤有+5氧化态;铀、镎、镅有+5和+6氧化态,镎和钚还有+7氧化态,可以MO娚、MO卂、MO幯等离子形式存在(镧系元素中最高氧化态为+4);锎、锿、镄、钔和锘等元素都有+2氧化态。锕系与镧系的这种差别是因为轻的锕系元素中5f电子激发到6d轨道所需能量比相应的镧系元素中4f电子激发到5d轨道的能量要小,使得锕系元素比镧系元素有更多的成键电子,因而出现较高的氧化态;而重的锕系元素却正好相反。
镧系元素的化学性质比较活泼。新切开的有光泽的金属在空气中迅速变暗,表面形成一层氧化膜,它并不紧密,会被进一步氧化,金属加热至200~400℃生成氧化物。金属与冷水缓慢作用,与热水反应剧烈,产生氢气,溶于酸,不溶于碱。金属在200℃以上在卤素中剧烈燃烧,在1000℃以上生成氮化物,在室温时缓慢吸收氢,300℃时迅速生成氢化物。镧系元素是比铝还要活泼的强还原剂,在150~180℃着火。镧系元素最外层(6S)的电子数不变,都是2。而镧原子核有57个电荷,从镧到镥,核电荷增至71个,使原子半径和离子半径逐渐收缩,这种现象称为镧系收缩。由于镧系收缩,这15种元素的化合物的性质很相似,氧化物和氢氧化物在水中溶解度较小、碱性较强,氯化物、硝酸盐、硫酸盐易溶于水,草酸盐、氟化物、碳酸盐、磷酸盐难溶于水。
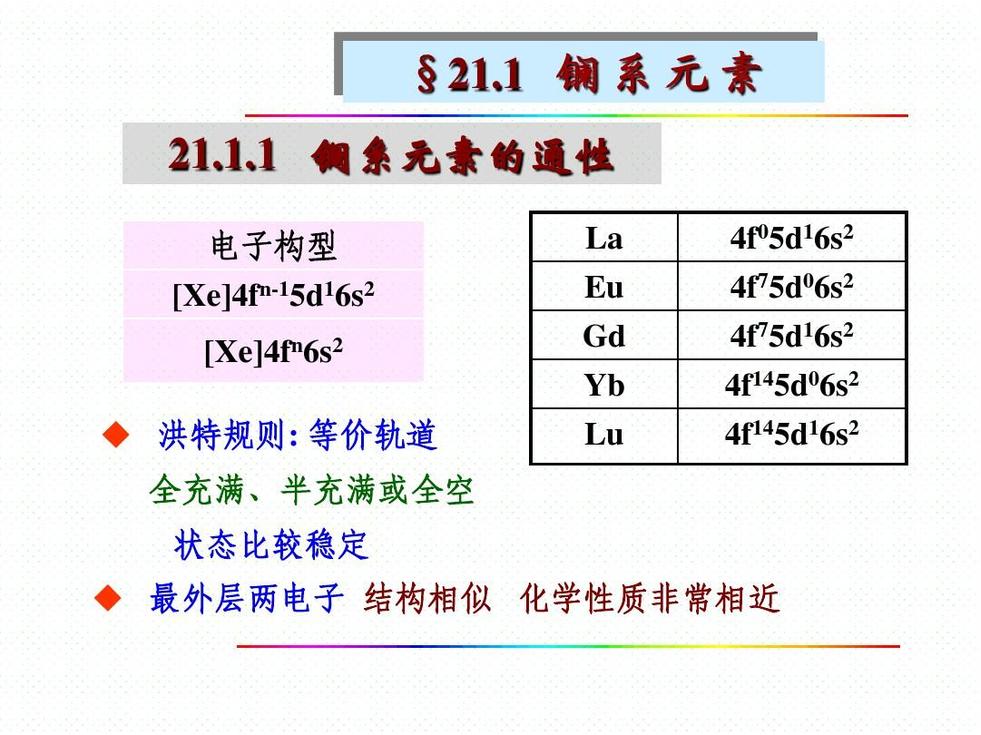
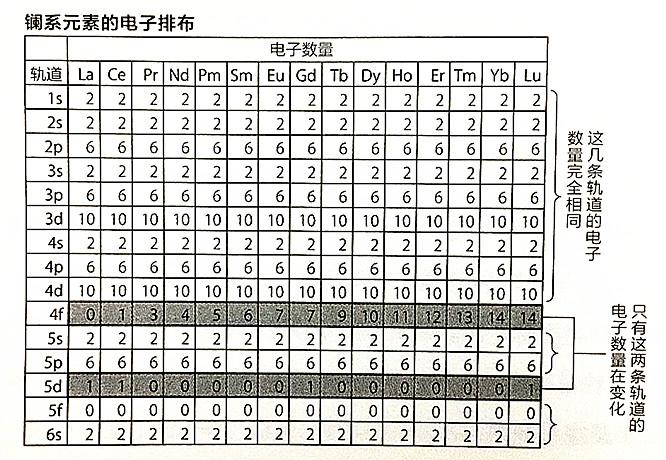
电子构型
镧系元素的外层和次外层的电子构型基本相同,电子逐一填充到4f轨道上。镧系元素也属于过渡元素,只是镧系元素新增加的电子大都填入了从外侧数第三个电子层(即4f电子层)中,所以镧系元素又可以称为4f系。为了区别于元素周期表中的d区过渡元素,故又将镧系元素(及锕系元素)称为内过渡元素。镧系元素原子基态的电子构型是4f0~145d0~16s2。
争论
镥(Lu)是否属于镧系元素有争论。最近的色谱分析显示,镥和铹应属于IIIB族,而非镧系和锕系。但为了方便叙述,现今仍习惯将其与镧系合称。参见锕系元素中关于铹的地位的争论。
镧系金属











