电子亲和能电子亲和能是指真空的自由电子能级与导带底能级之间的能量差,也就是把导带底的电子拿出到真空去而变成自由电子所需要的能量。电子亲和能是衡量原子核与外来电子之间吸引力的指标。电子亲和能:对于原子而言,一个中性原子获得一个电子而成为负离子时所放出的能量,就是原子的亲和能。这样,原子核与外来电子之间的距离便成为决定性因素了,随着族内元素原子序数的增加,原子核与外来电子之间的距离也越来越远(原子半径越来越大),它们间的吸引力越来越小,释放的能量(电子亲和能)越来越少。
精选百科
本文由作者推荐
电子亲和能相关的文章
死亡是一种自然现象,即生物失去生命,它是一切生命有机体发展的必然归宿。随着医学科技的发展,患者的心跳、呼吸、血压等生命体征都可以通过一系列药物和先进设备加以逆转或长期维持。而脑死亡是全脑功能包括脑干功能不可逆的终止。人体的呼吸中枢位于脑干,如果脑干发生结构性破坏,会直接导致呼吸功能停止,无论采取何种
完颜,是女真最古老的姓氏之一,来源先秦肃慎汪谷截氏,汉语读作:wán yán。凡姓完颜者,为金朝皇族或赐姓家族。灭国后多改为颜、王、符、汪、完、顾、银、金等汉姓完颜满语拉丁文转写为:wanggiya亦或wanggiyan,‘完颜’二字为古代女真语音译。
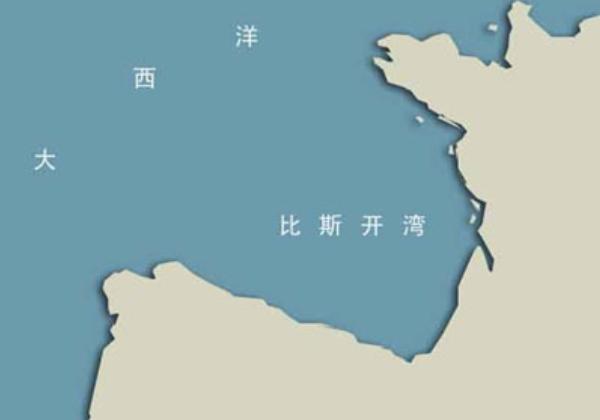
比斯开湾(英文:BayofBiscay;法文:GolfedeGascogne;西班牙语:GolfodeBizkaia),北大西洋东部海湾,介于法国西海岸和西班牙北海岸之间,略呈三角形。比斯开湾位于北大西洋的东北部,东临法国,南靠西班牙,面积19.4万平方公里,总体积约33.2万立方公里,平均深度1715米,最大深度5120米。

尚可名片
这家伙太懒了,什么都没写!
作者