在一定温度下,可逆反应达到平衡时,产物浓度计量系数次方的乘积与反应物浓度计量系数次方的乘积之比为平衡常数。若在上面的平衡常数表达式中,若各物质均以各自的标准态为参考态,所得的平衡常数为标准平衡常数。其由来是因为平衡常数Kc、Kp、Kx都称为实验平衡常数,使用时有两方面的困难,一个是Kc的单位是(mol·dm),取决于Δn,Kp的单位为Pa,只有当Δn=0时,Kc、Kp的量纲为1,使用时容易出现混乱。二是对于涉及固、液、气三态的反应时,平衡常数难以表示。于是,人们提出了标准平衡常数。
精选百科
本文由作者推荐
标准平衡常数相关的文章
西晋(公元265年—公元316年)是中国历史上三国时期之后的大一统王朝之一,另与东晋合称晋朝。传四帝,国祚五十一年。若以灭东吴始,则仅立朝37年。为了区别于东晋,史称西晋,两晋又被称为司马晋。
鸠摩罗什(公元343/344-413年)是佛教著名译经学家,原名“Kumarajiva”,亦音译为鸠摩罗耆婆、拘摩罗耆婆、究摩罗耆婆等,简称罗什、耆婆、什、什师,意译为童寿,即“Kumara”在梵文中有“少年、童子”的意思,梵文“jiva”则有“寿命、生存”的意思。鸠摩罗什祖籍是天竺人,公元343或
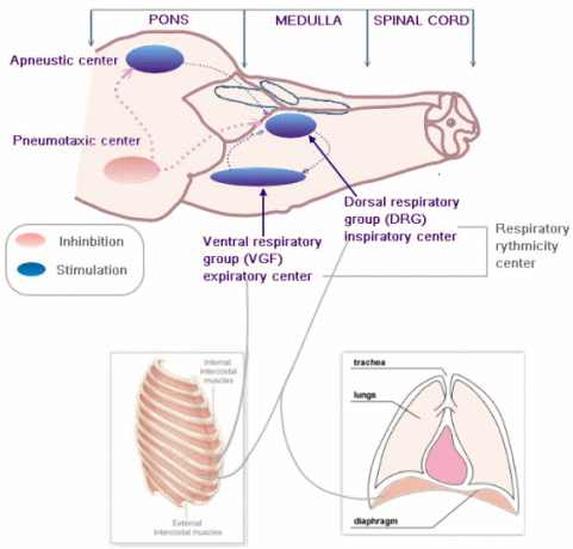
呼吸中枢参与呼吸节律产生调节的细胞群呼吸中枢(respiratory center)是指中枢神经系统内产生呼吸节律和调节呼吸运动的神经细胞群。在对呼吸中枢定位研究的诸多实验中,具有重要价值的是1923年由英国的生理学家拉姆斯登(Lumsden)对猫的脑干进行的分段横切实验。呼吸中枢分布在大脑皮层、间脑、脑桥、延髓和脊髓等各级部位,参与呼吸节律的产生和调节,共同实现机体的正常呼吸运动。延髓呼吸中枢具
植物的丛生茎下各自都有根,可以直接把它们分开,形成独立的植物,这种繁殖方法叫做分根。例子:夹竹桃、腊梅等。分根是农学上的术语,指分割根的一部分埋入地中以进行繁殖的方法。

尚可名片
这家伙太懒了,什么都没写!
作者