介绍
用二维坐标绘成的气液相平衡关系曲线,称为溶解度曲线,可在有关手册中查得或通过实验对具体物系进行测定。图1、图2分别表示在同一压强、不同温度下,NH和SO在水中的溶解度曲线。
曲线图
溶解度曲线上的任一点表示平衡状态时的气、液组成,说明要使一种气体在溶液里达到某一浓度,液面上方必须维持该气体一定的平衡分压。分析图1或图2可知,同一种物系,在相同温度下,气体的溶解度随着该组分在气相中的分压增大而增大;在相同的平衡分压下,气体的溶解度随着温度的升高而减小。
溶解度曲线
由图3可知,在相同的温度和同一分压下,不同的气体,在同一种溶剂中的平衡组成差别很大。从上面讨论我们了解到:①在一定的温度下,气体在溶液里达到某一组成,被溶解的气体都呈现一定的分压。从这一点看,可视为有三种气体:易溶的气体(氨)、中等可溶的气体(二氧化硫)、微溶的气体(二氧化硫)。分析下表可以看出,微溶气体与液体接触时,需要的液面上方分压较大,而易溶气体液面上方需要的分压较小。②根据溶解度曲线的变化规律,可知,加压和降温有利于吸收过程的进行;相反,升温或减压则有利于解吸过程的进行。
溶解度曲线
意义
①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;④根据溶解度曲线能进行有关的计算。
曲线上点的意义
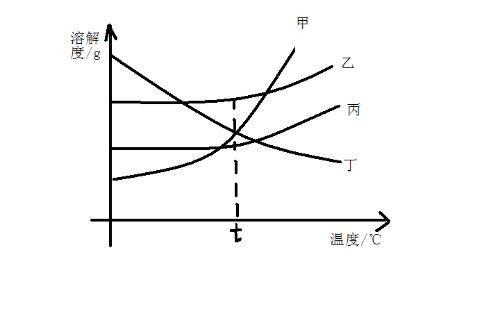
溶解度曲线
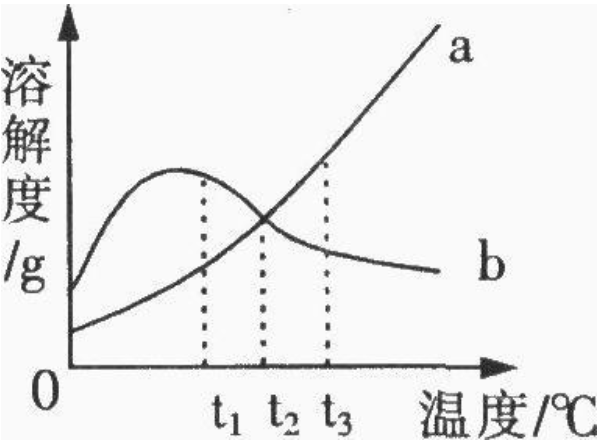
1.溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。溶解度曲线下的点表示物质在该点所示温度上的溶解度,溶液所处的状态是不饱和溶液。2.溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应温度时的不饱和溶液。
3.溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
4.两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
曲线上线的意义
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用: (1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。 (2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小。 (3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
曲线上面的意义
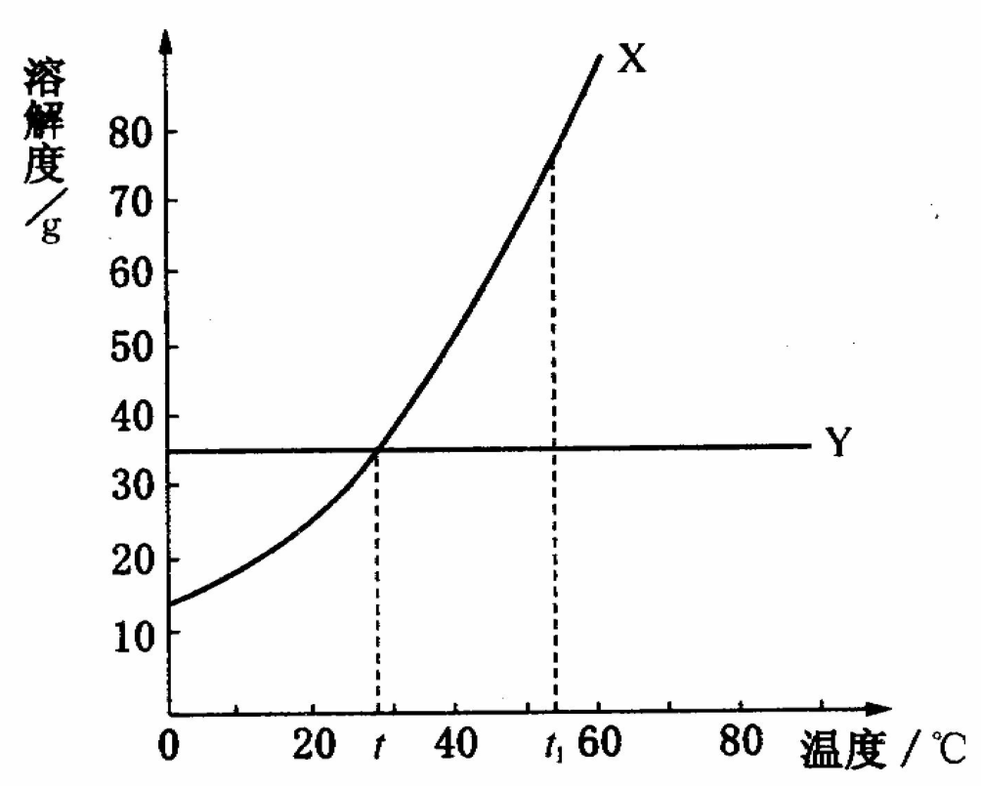
对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
曲线交点的意义
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
变化规律
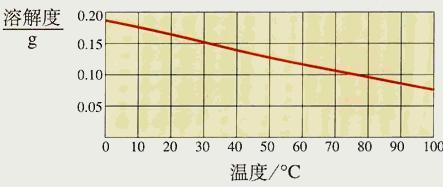
熟石灰的溶解度随温度升高而降低
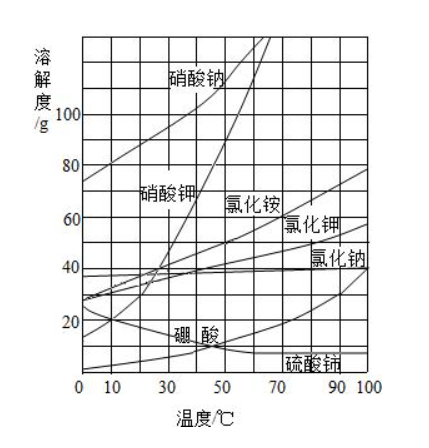
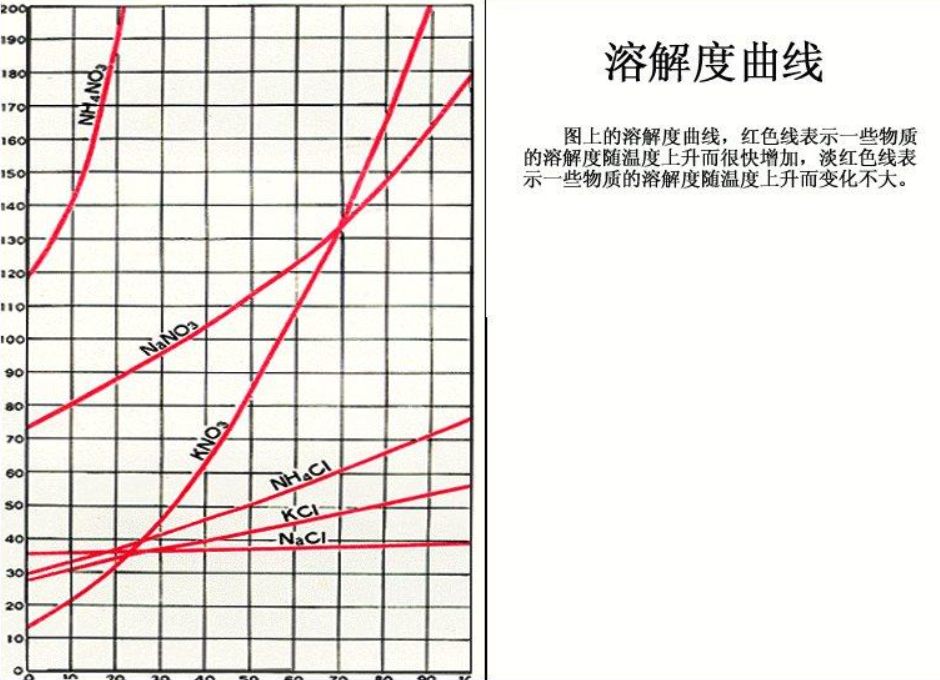
1.大多数固体物质的溶解度随温度升高而增大,曲线为“陡升型”,如硝酸钾。2.少数固体物质的溶解度受温度的影响很小,曲线为“缓升型”,如氯化钠。
3.极少数固体物质的溶解度随温度的升高而减小,曲线为“下降型”,如氢氧化钙。
4.气体物质的溶解度均随温度的升高而减小(纵坐标表示体积),曲线也为“下降型“,如氧气。
曲线的测定
当溶质原子溶入溶剂而形成固溶体时,仍保持原溶剂的固有点阵,但点阵参数则随溶质量的增多而增大(或减小)。
取A、B含量不同的一系列成分已知的合金,加热至使B全部溶入A中而形成同溶体,淬火至室温,精确测定各合佥的点阵参数a。作出溶解量与点阵参数a的关系曲线(如图a)。当溶解量不大时,所得为一直线。
若事先作出该关系曲线,则可根据所测某固溶体的点阵参数得出其中溶质的含量。
为测得溶解度曲线,取B含量足够高的合金,在温度t下长时间保温,精确测定该固溶体的点阵参数a,在已建立的图a中作出a的水平线,与直线相交于一点,该点所对应的成分即为固溶体的成分,亦即在温度t下B在A中的溶解度。同样可以测出t等其它温度下的溶解度。将各温度下的溶解度连接起来,即得出固溶体的溶解度曲线(图b)。此法称为外标法。
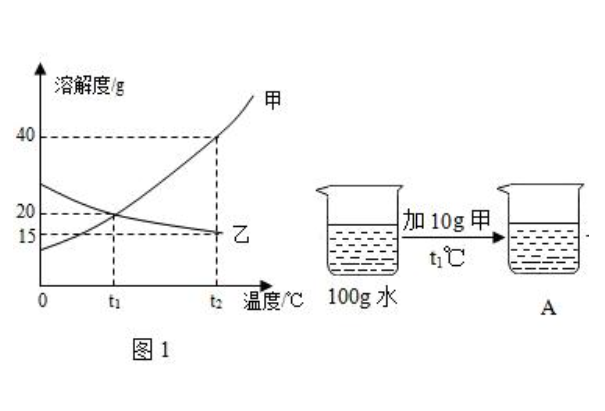
溶解度曲线
萃取平衡
对A与B、S完全互溶、B与S部分互溶的萃取系统,其平衡关系可借助实验测定之。具体步骤是:在恒定压强及温度的条件下,先将B和S以适当比例混合,其总组成由M点表示。经过充分接触和静置后,便得到两个互为平衡的液相,
其组成如下图中的E点和R点所示。这两个互为平衡的液相称为共轭相,其相应的组成称为共轭组成。向此混合液中加入少量A并充分混合,使之达到新的平衡,静置后分层得到一对共轭相,其组成点为E和R。然后继续加入溶质A,重复上述操作,即可得到若干对共轭相的组成点E和R,直至加入A的量使混合液恰好由两相变为一相,其组成点由P表示。再加入A,混合液保持单一液相状态。P点称为临界混溶点。将代表各平衡液相组成的点连接起来,便得到实验温度下该三元物系的溶解度曲线。
溶解度曲线将三元系分为两个区域:由溶解度曲线与底边所围成的区域为两相区,溶解度曲线以外的区域为均相区。在两相区,互成平衡的萃取相E和萃余相R称为共轭相,是萃取分离可能达到的极限组成。
显然,萃取分离应控制在两相区内进行,实际萃取过程因接触程度不够,故萃取相和萃余相的组成低于共轭组成,但其相对量符合杠杆规则。
在相同温度下,萃取剂与组分B的互溶度越小,其两相区的面积越大,所得萃取相的组成也越大;反之亦然。因此,应尽可能选择与组分B有较小互溶度的萃取剂以有利于溶质A的分离。
若组分B与组分S完全不互溶,则点R0与E0分别与三角形定点B及定点S相重合。
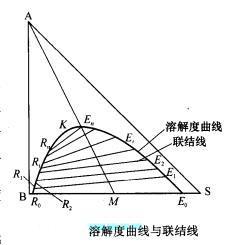
溶解度曲线与联结线
应用
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。