氯化镭,化学式RaCl2,是第一种被制出的镭化合物,由玛丽·居里制得。金属镭最初由汞电极电解氯化镭溶液制得。
精选百科
本文由作者推荐
氯化镭相关的文章
小编整理:马涛,湖北省委原常委、省军区原司令员。马涛,男,汉族,1961年6月生,中国共产党党员,中国人民解放军少将军衔。曾任湖北省委常委、省军区司令员。湖北省国防动员委员会副主任。马涛湖北省军区原司令员马涛,男,1961年6月生,中共党员,中国人民解放军少将
晏晓陶,女,原TVB国语配音演员,曾为多部电视剧和电影进行配音。她的代表作品包括《神雕侠侣》《冤家易结不易解》《梁祝》以及2004年的《金枝欲孽》中的安茜。1994年,她为《梁祝》中的杨采妮配音,1996年为电影《甜蜜蜜》中的张曼玉配音。晏晓陶的丈夫是香港男高音歌唱家、国语配音演员黄河,他最为人所知
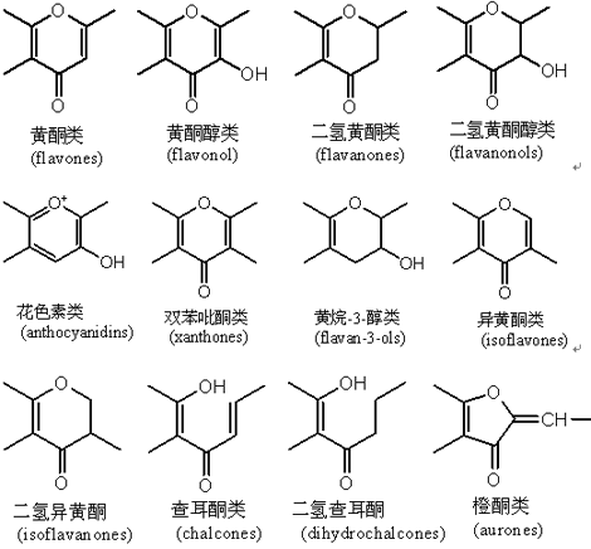
黄酮黄酮类化合物的总称黄酮(flavone),是黄酮类化合物的总称,泛指两个具有酚羟基的苯环(A-与B-环)通过中央三碳原子相互连结而成的一系列化合物。黄酮类化合物结构中常连接有酚羟基、甲氧基、甲基、异戊烯基等官能团。黄酮类化合物(英语:Flavonoid,又称类黄酮)是指基本母核为2-苯基色原酮类化合物,现在则泛指两个具有酚羟基的苯环通过中央三碳原子相互连接的一系列化合物。他们来自于水果、蔬菜、
去特若尸逐就单于栾提休利,为南匈奴湖斜尸逐侯鞮单于之子,乌稽侯尸逐鞮单于之弟,128年单于拔死后由他继位。 140年夏,南匈奴左部句龙王吾斯、车纽等叛汉,率三千余骑寇西河,杀朔方、代郡长史。五原太守、护匈奴中郎将陈龟以单于不能制下,逼迫去特若尸逐就单于自杀。

尚可名片
这家伙太懒了,什么都没写!
作者