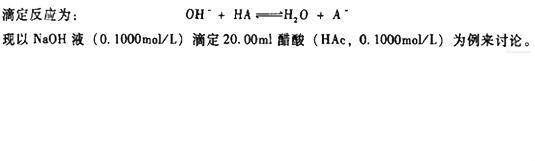
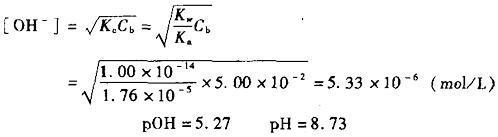强碱滴定弱酸是一种化学研究方法。
强碱滴定弱酸相关的文章
有机化合物一般是指含碳氢键的化合物,因此不包括碳氧化物(如一氧化碳、二氧化碳)、碳酸盐、氰化物、硫氰化物、氰酸盐、金属碳化物等物质。但是,部分不包含碳氢键的化合物,如四氯化碳等全卤代烃,可以看作氢原子被卤素取代的产物,仍属于有机化合物。
小编整理:神功是武则天使用的年号,这个年号属于唐朝,使用时间是679年九月—681年二月。此外,这个年号是武则天在位期间使用的最后一个年号,她在位期间还使用了其他一些年号,比如光宅、垂拱、永昌、载初等。总的来说,神功是一个历史上的年号,它代表了一个时期的历史事
大理石(Marble)是指由碳酸盐矿物经变质作用(区域变质与接触变质为主)后再结晶形成的具有明显粒状变晶结构的石灰质变质岩。其主要矿物成分是方解石和白云石,主要化学成分是CaCO3。大理石分布较零星,主要分布在地缝合带的变质岩区。世界主要产地是中国、意大利、法国、英国、德国、荷兰、比利时、瑞士、丹麦
胡杨(拉丁学名:Populus euphratica),别名:胡桐、英雄树、异叶胡杨、异叶杨、水桐、三叶树、幼发拉底杨等,是杨柳科(Salicaceae)杨属(Populus)一种落叶中型天然乔木植物。主要分布于蒙古、埃及、叙利亚、印度、伊朗、阿富汗、巴基斯坦等地区,在中国主要分布于内蒙古西部、甘肃
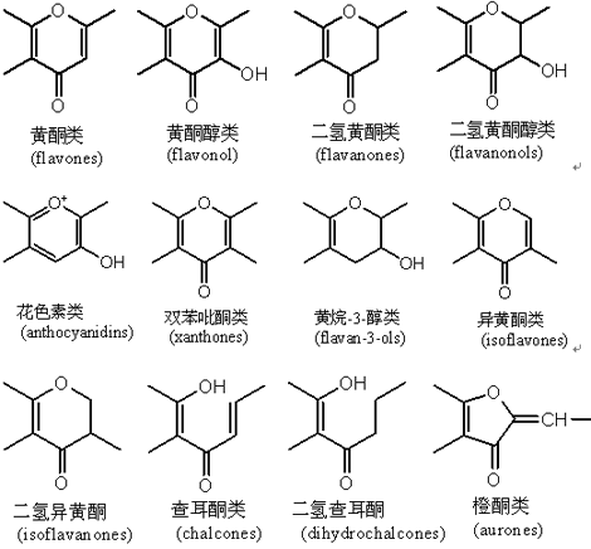
黄酮黄酮类化合物的总称黄酮(flavone),是黄酮类化合物的总称,泛指两个具有酚羟基的苯环(A-与B-环)通过中央三碳原子相互连结而成的一系列化合物。黄酮类化合物结构中常连接有酚羟基、甲氧基、甲基、异戊烯基等官能团。黄酮类化合物(英语:Flavonoid,又称类黄酮)是指基本母核为2-苯基色原酮类化合物,现在则泛指两个具有酚羟基的苯环通过中央三碳原子相互连接的一系列化合物。他们来自于水果、蔬菜、

尚可名片
这家伙太懒了,什么都没写!