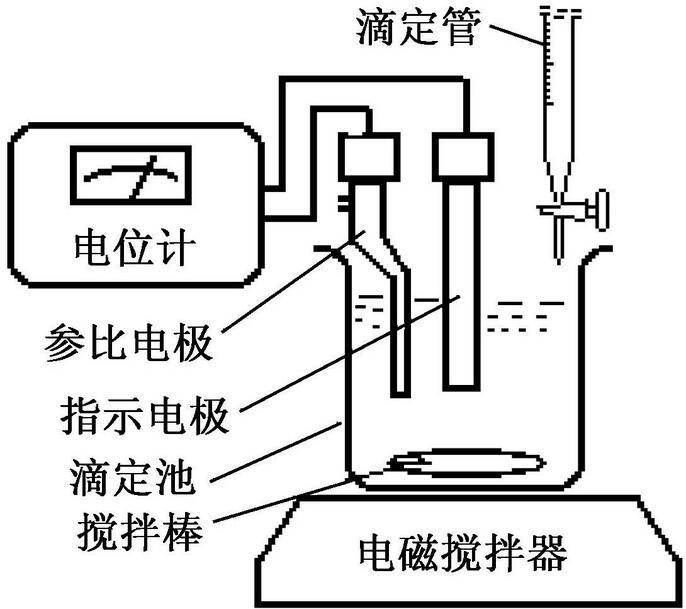
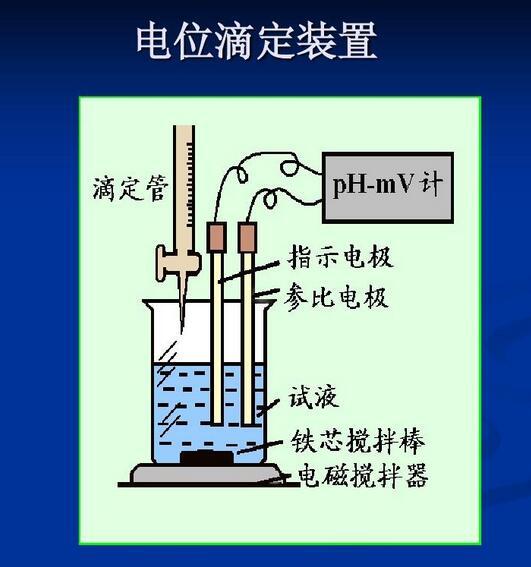
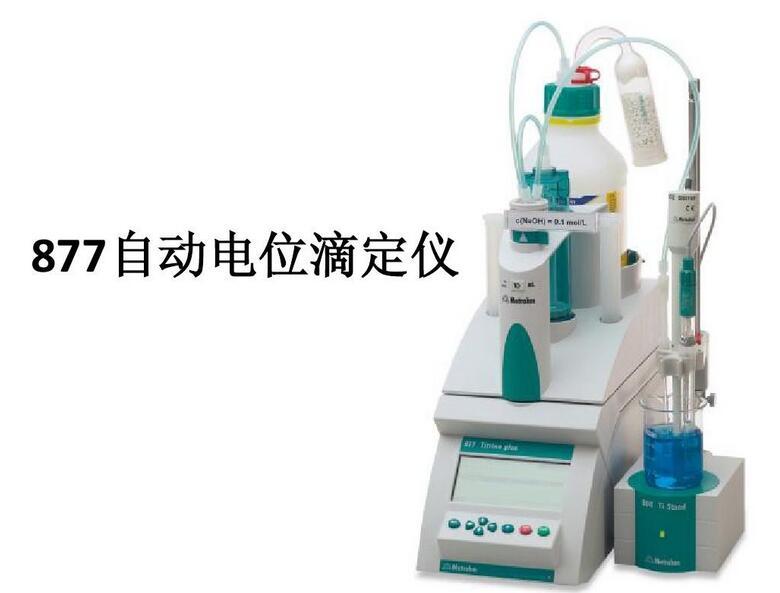
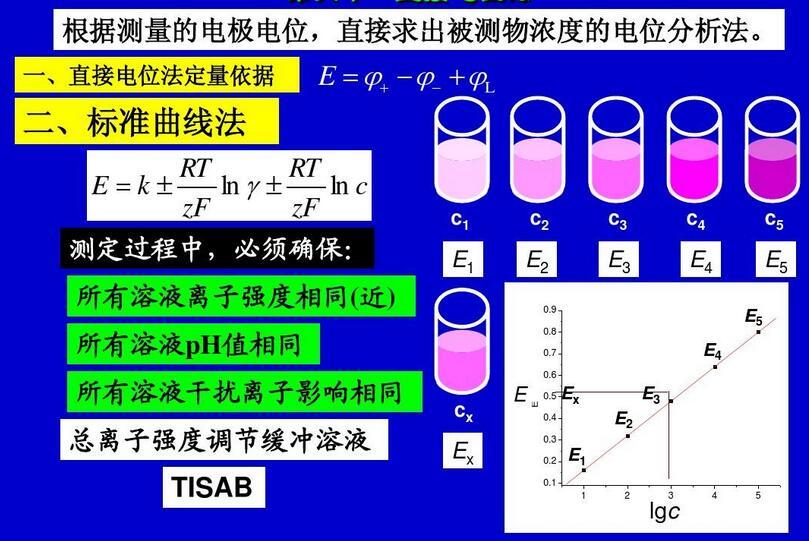
电位滴定法,专业术语,拼音为diàn wèi dī dìng fǎ,是在滴定过程中通过测量电位变化以确定滴定终点的方法,和直接电位法相比,电位滴定法不需要准确的测量电极电位值,因此,温度、液体接界电位的影响并不重要,其准确度优于直接电位法,普通滴定法是依靠指示剂颜色变化来指示滴定终点,如果待测溶液有颜色或浑浊时,终点的指示就比较困难,或者根本找不到合适的指示剂。电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定到达终点前后,滴液中的待测离子浓度往往连续变化n个数量级,引起电位的突跃,被测成分的含量仍然通过消耗滴定剂的量来计算。
电位滴定法相关的文章
对乙酰氨基酚(英文:Paracetamol、acetaminophen),又名扑热息痛,为苯胺类解热镇痛药,可用于发热、头痛、关节痛等,不良反应较少,偶尔可见恶心、呕吐、出汗、腹痛等,过量使用可导致肝损伤甚至死亡。对乙酰氨基酚纯品为白色结晶或结晶性粉末,味微苦,无臭。对乙酰氨基酚可通过口服、肌肉注射
棕榈 zōng lǘ(学名:Trachycarpus fortunei),又称棕树、唐棕、铁扇棕、鬣葵等,是棕榈属的一种常绿乔木。棕榈广泛栽培于中国、日本、印度、缅甸、美国、欧洲南部等暖温带地区;在中国主要分布在秦岭以南,除西藏外的各省(自治区、直辖市)如广东、云南、上海等。多生长在海拔2000米以
巴尔干半岛(Balkan Peninsula),是一个历史和地理上的名词,用以描述欧洲的东南隅位于亚得里亚海和黑海之间的陆地,详细的范围依照定义不同有许多种说法。巴尔干一词是由土耳其语的“山脉”一词派生出来的。
塔克拉玛干沙漠(含义:“胡杨树之乡”、“多胡杨树的地方”),别称“死亡之海”,位于中国新疆塔里木盆地的中央,东面有祁连山,西面是阿赖山与塔吉克斯坦共和国接壤,南面是昆仑山,北面是天山。塔克拉玛干沙漠分属于新疆维吾尔自治区巴音郭楞蒙古自治洲、喀什市、和田市和阿克苏地区。塔克拉玛干沙漠是中国最大的沙漠,
蕈(拼音:xùn)树(学名:Altingia chinensis (Champ. ex Benth.) Oliv. ex Hance)为蕈树科(Altingiaceae)蕈树属(Altingia)常绿乔木,别名山锂枝、阿丁枫等。蕈树原产于中国长江流域以南的各地,越南也有分布,多生长在海拔400-16
《科幻世界》(英文名:Sci-Fi World,缩写SFW)是科幻世界杂志社出版的科幻类杂志。创刊于1979年,前身是《奇谈》和《科学文艺》,是中国乃至世界发行量最大的科幻小说杂志,曾获得“世界科幻协会最佳期刊奖”、“中国国家期刊奖提名奖”,并入选“中国百种重点社科期刊”、“双奖期刊”,曾承办过1991年世界科幻协会年会,是中国科幻期刊中一面历久弥新的金牌。杨潇,阿来,秦莉曾先后任杂志社社长,其中阿来任社长期间曾以《尘埃落定》获茅盾文学奖。

尚可名片
这家伙太懒了,什么都没写!