三硫化二是一种无机化合物,铁(化学式:Fe2S3,分子量为207.9),是三种铁的硫化物(iron sulfide)之一,它是一种固体黑色粉末,常温下易转变为黄绿色。 在空气中容易被氧化,因此自然界中不存在,只能通过实验室化学方法制备。
精选百科
本文由作者推荐
三硫化二铁相关的文章
脑血管畸形是指先天性脑血管发育异常,病变在出生时已存在,但首发症状多见于年轻人。脑血管畸形主要分为四类:动静脉畸形、海绵状血管瘤、毛细血管扩张症和静脉畸形,其中动静脉畸形最为常见。在胚胎早期,原始的动静脉是相互交通的,动静脉畸形由于局部血管发育异常,动静脉仍以直接沟通的形式遗留下来。血液由动脉直接进
葡萄酒(汉语世界有时以红酒称之)是经过发酵的葡萄或葡萄汁制作而成的酒精饮料。葡萄酒主要由水和酒精(乙醇)组成,但也有芳香化合物、酸、酚类物质、二氧化碳等其他物质。一般葡萄酒中酒精含量7%到16%(体积分数),但在部分特种葡萄酒中,酒精含量可达20%(体积分数)。
刘慈欣谈科幻《刘慈欣谈科幻(第1辑)》有作者在创作科幻小说时的心路历程,有作者对一些经典科幻作品的精彩书评、影评,还有一些对话与访谈,折射出作者作为一个科幻迷对科幻、对未来的看法,也展现出科幻作家独特的浪漫主义情怀。
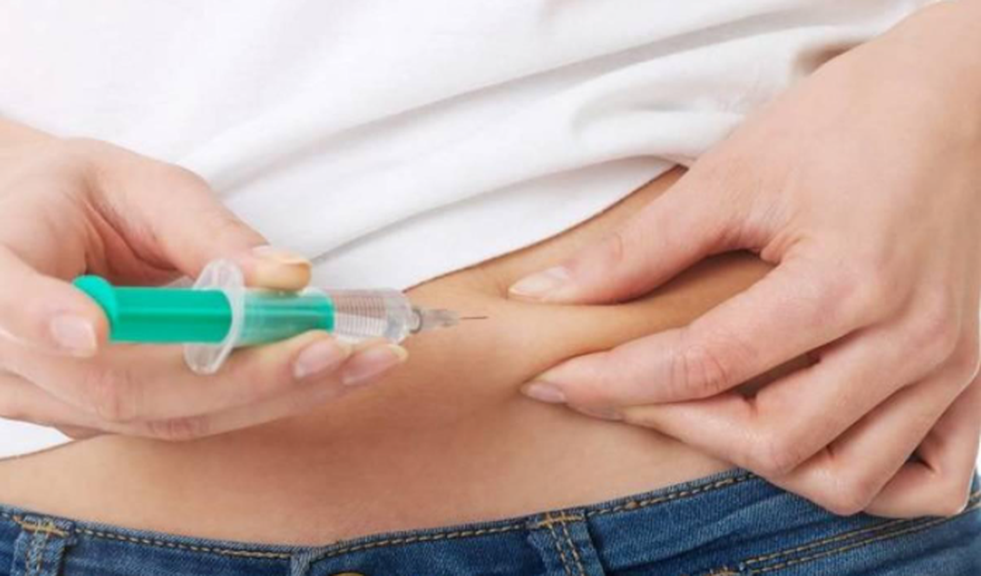
胰岛素蛋白质激素名称胰岛素(Regular insulin)可增加葡萄糖的利用,能加速葡萄糖的无氧酵解和有氧氧化,促进肝糖原和肌糖原的合成和贮存,并能促进葡萄糖转变为脂肪,控制糖原分解和糖异生,因而能使血糖降低。此外,本品能促进脂肪的合成。抑制脂肪分解,使酮体生成减少,纠正酮症酸血症的各种症状。能促进蛋白质的合成,抑制蛋白质分解。本品和葡萄糖同用时,可促使钾从细胞外液进入组织细胞内。

尚可名片
这家伙太懒了,什么都没写!
作者