依据是否具有在熔融态或水溶液中导电的能力,可以将化合物分为电解质和非电解质。作为一种分布极为广泛的化合物,水,它实际上也是一种极弱的电解质。 尽管在日常生活中纯水看似是不导电的,但是在灵敏度极高的电流计检测下,仍然是能够检测到极其微弱的电流,这表明纯水中存在导电的粒子。
水的电离相关的文章
脊髓小脑性共济失调是基因变异引起的神经系统疾病,属于遗传性疾病。脊髓小脑性共济失调是家族遗传性疾病,多于青少年期和中年期发病。基因变异导致机体各系统产生功能变化,尤其引起神经病变。脊髓小脑性共济失调有多种亚型,共同的临床表现有步履不稳、肢体摇晃、动作反应迟缓、发音含糊不清等。脊髓小脑性共济失调无特殊
矢泽爱(日文:矢沢 あい),日本漫画家、插画家,1967年3月7日出生于日本兵库县。主要作品有《一起去吹吹风》《天堂之吻》《娜娜》《近所物语》《圣学园天使》等。
山西本词条是多义词,共3个义项中华人民共和国省级行政区山西,简称“晋”,中华人民共和国省级行政区,省会太原,位于中国华北,东与河北为邻,西与陕西相望,南与河南接壤,北与内蒙古毗连,介于北纬34°34′—40°44′,东经110°14′—114°33′之间,总面积15.67万平方千米。山西省地势呈东北斜向西南的平行四边形,是典型的为黄土覆盖的山地高原,地势东北高西南低。高原内部起伏不平,河谷纵横,地
剑桥大学世界著名的公立研究型大学剑桥大学(英文名称:University of Cambridge;勋衔:Cantab),坐落于英国剑桥,是一所世界著名的公立研究型大学,采用书院联邦制。其与牛津大学、伦敦大学学院、帝国理工学院、伦敦政治经济学院同属“G5超级精英大学”。剑桥大学是英语世界中第二古老的大学,前身是一个于1209年成立的学者协会。八百多年的校史汇聚了牛顿、开尔文、麦克斯韦、玻尔、霍金、
阿布基尔,埃及地中海沿岸村庄。在亚历山大东北21公里。东面的阿布基尔湾是渔场, 1798年尼罗河海战中,英、法舰队激战于此,法全军覆没,对拿破仑远征埃及的失败有重大影响。附近有海上天然气田,1977年开采。天然气通过管道供应亚历山大地区工业部门和电站,还供应阿布基尔化肥厂作原料。
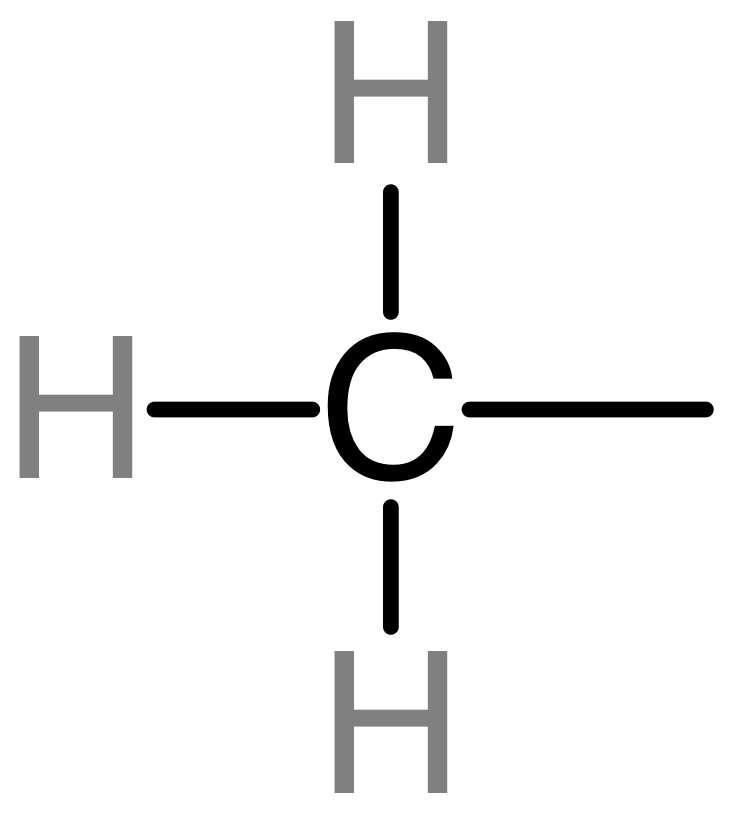
甲基(methyl group),甲烷分子中去掉一个氢原子后剩下的电中性的一价基团。由碳和氢元素组成。甲基作为一个化学基团(-CH3),它能够结合在DNA上某些特定部位,这个甲基和DNA结合过程叫甲基化,相反,甲基从DNA上脱落的过程就叫做去甲基化。

尚可名片
这家伙太懒了,什么都没写!