synuclein相关的文章
菊目,拉丁学名Asterales,为显花植物的一目,仅菊科 一科,是显花植物 最大的科。分部广布全世界,热带较少,草本,半灌木或灌木,稀乔木,有乳汁管和树脂道,最显著特点是头状花序,多为一至多年生草本,生长于温带和亚热带的向阳处,分布范围从北极到南极,从海岸到树木线以上的高山。
唐朝(英语TangDynasty,公元618年—公元907年),也是继隋朝后的又一个统一的中原政权。唐朝共计二百八十九年,共经历二十一位皇帝统治。唐朝在中国历史上具有独特地位。其是封建时代国力最为强盛,统治时间最为悠久的王朝之一。唐朝疆域辽阔,国境内民族众多相处和谐。
肌肉痉挛肌肉痉挛(俗称抽筋),是一种肌肉自发的强直性收缩。发生在小腿和脚趾的肌肉痉挛最常见,发作时疼痛难忍,可持续几秒到数十秒钟之久。尤其是半夜抽筋时往往把人痛醒。腿常抽筋大多是缺钙、受凉、局部神经血管受压引起。平时可适量补钙,多晒太阳,坐姿睡姿避免神经血管受压,也可做局部肌肉的热敷、按摩,加强局部的血液循环,如果还无改善,就应到医院检查治疗。肌肉痉挛(俗称抽筋),是一种肌肉自发的强直性收缩。发生
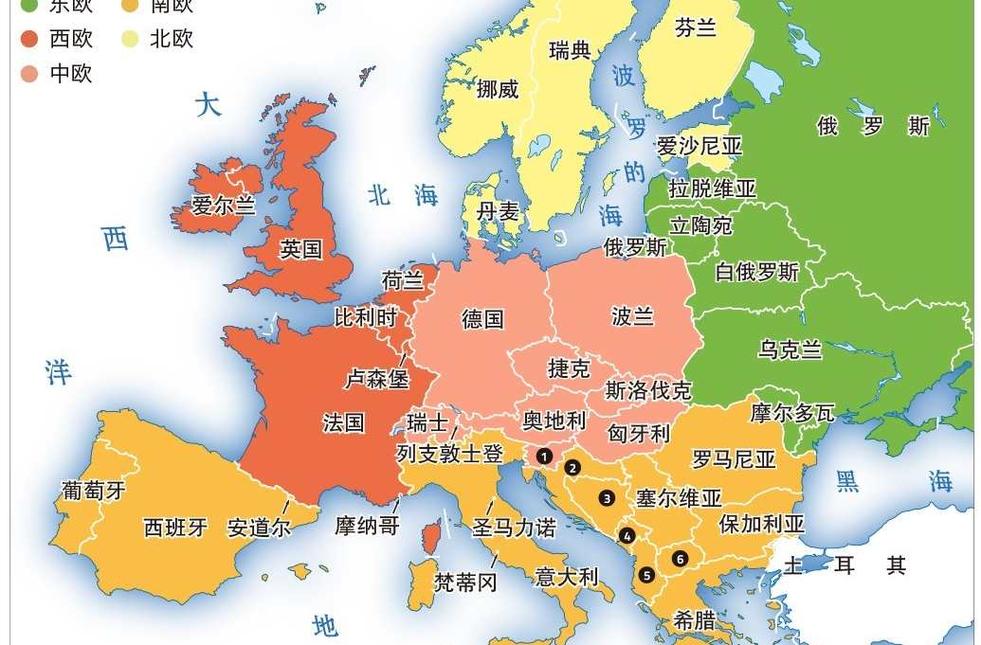
南欧欧洲南部的简称南欧(southern Europe)是欧洲南部的简称,范围包括伊比利亚半岛、亚平宁半岛及巴尔干半岛南部,包括西班牙、葡萄牙、安道尔、意大利、希腊、马耳他、梵蒂冈、圣马力诺、斯洛文尼亚、克罗地亚、阿尔巴尼亚、罗马尼亚、保加利亚、塞尔维亚、黑山、马其顿和波斯尼亚和黑塞哥维那共17个国家,也称为地中海欧洲,因为大多南欧国家靠近地中海。面积约为166万多平方公里。南欧隔着地中海与亚、非
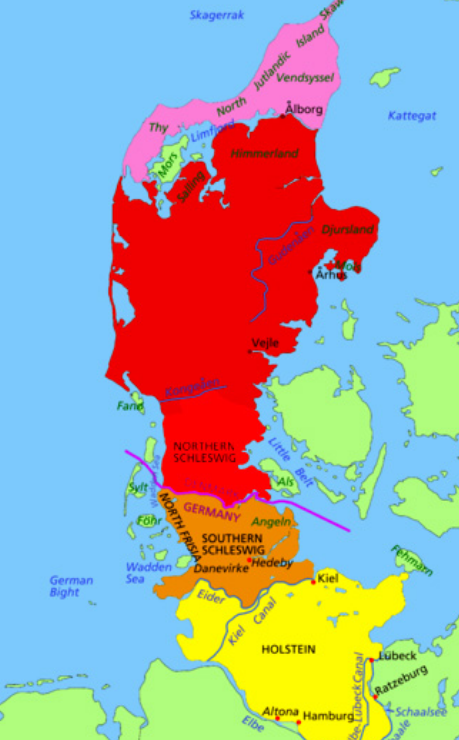
日德兰半岛(英文:Jutland;德文:Jütland;丹麦文:Jylland;低地德文:Jö;tlann),是欧洲北部的半岛,面积约25485平方公里,位于北海和波罗的海之间,构成丹麦国土的大部分。西和北为北海和斯卡格拉克海峡,东为卡特加特海峡和小贝尔特海峡。人口约235万。古代地理上称为西姆布里卡半岛。从广义上说,包括德国石勒苏益格-荷尔斯泰因州。

尚可名片
这家伙太懒了,什么都没写!