研究简史
812次播放01:18牙医发现笑气“麻醉”18世纪下叶,英国化学家約瑟夫·普利斯特里(Joseph Priestley)首次发现并人工合成了一氧化二氮,而随后汉弗莱·戴维(Humphry Davy)的研究让该气体闻名遐迩,戴维发现一氧化二氮具有麻醉作用并致人发笑。笑气(laughing gas)自此得名,并在之后的200年内被广泛地用于产科及牙科的术中止痛。正是一氧化二氮被吸入后,身体上所产生的欣快感、迷幻感觉及轻度麻醉效果,使得一氧化二氮从19世纪开始就被当做消遣性药物使用[3]。
一氧化二氮是约瑟夫·普利斯特里在1772年发现的,汉弗莱·戴维自己和他的朋友,包括诗人柯尔律治和罗伯特·骚塞在18世纪90年代试验了这种气体。他们发现一氧化二氮能使病人丧失痛觉,而且吸入后仍然可以保持意识,不会神志不清。不久后笑气就被当作麻醉剂使用,尤其在牙医师领域。因为通常牙医师无专职的麻醉师,而诊疗过程中常需要病患保持清醒,并能依命令做出口腔反应,故在此气体给牙医师带来极大的方便。
物质结构
一氧化二氮的分子是直线型结构。其中一个氮原子与另一个氮原子相连,而第二个氮原子又与氧原子相连。因此一氧化二氮可以被氧化为更高价的氮氧化物,如一氧化氮NO和二氧化氮NO2。将一氧化二氮与沸腾汽化的碱金属反应可以生成一系列的亚硝酸盐,在高温下,一氧化二氮也可以氧化有机物。
理化性质
物理化学性质一氧化二氮(Nitrous Oxide)是一种无色有甜味气体,是一种氧化剂,化学式N2O,在一定条件下能支持燃烧,但在室温下稳定,有轻微麻醉作用,并能致人发笑,能溶于水、乙醇、乙醚及浓硫酸[2]。
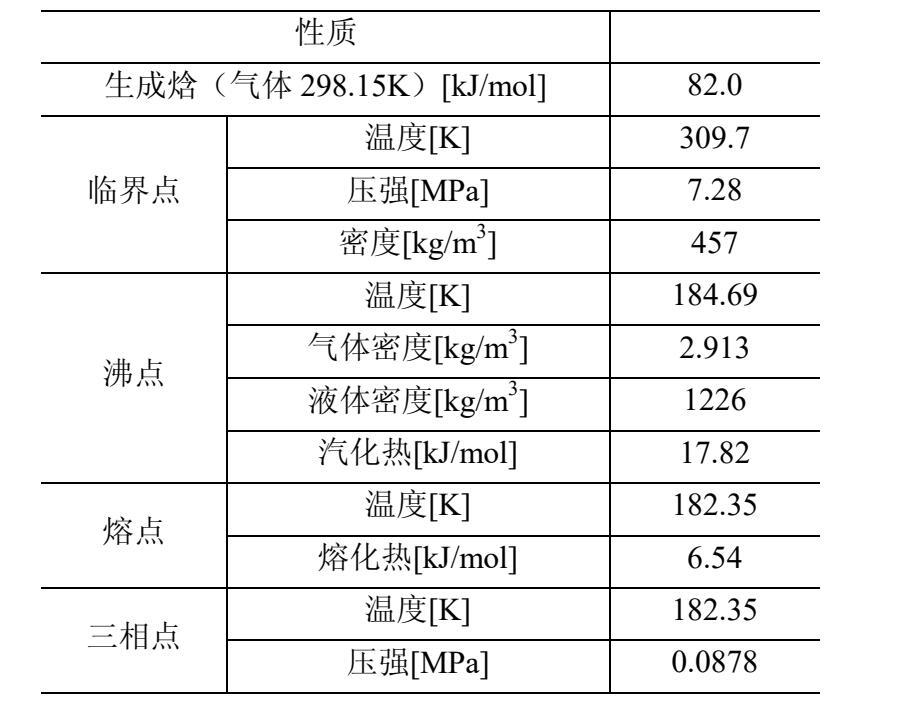
一氧化二氮的基本物理性质
稳定性在加热作用下能分解成其它元素,反应不可逆,并释放热量。产生的混合物含氧量大于空气中含氧量。650℃时发生分解,在催化剂(银、铂、铜、镍的氧化物)存在下,350℃发生分解。在这种状态下,由于一氧化二氮(N20)是一种助燃气体,就可能生成易燃易爆混合物[2]。
毒理学急性毒性:一氧化二氮作为吸入麻醉剂在医药上应用已久,已经很少用它了。吸入一氧化二氮和空气的混合物,当其中氧浓度很低时可致窒息;吸入80%一氧化二氮和氧气的混合物引致深麻醉,苏醒后一般无后遗作用。
俗称“笑气”的一氧化二氮是一种麻醉性气体,曾经广泛被应用于医学手术中。但“笑气”进入血液后会导致人体缺氧,长期吸食可能引起高血压、晕厥,甚至心脏病发作。此外,长期接触此类气体还可引起贫血及中枢神经系统损害等。[2]
制备方法
(1)在实验室,一般采用硝酸铵分解法来制备一氧化二氮。[4]

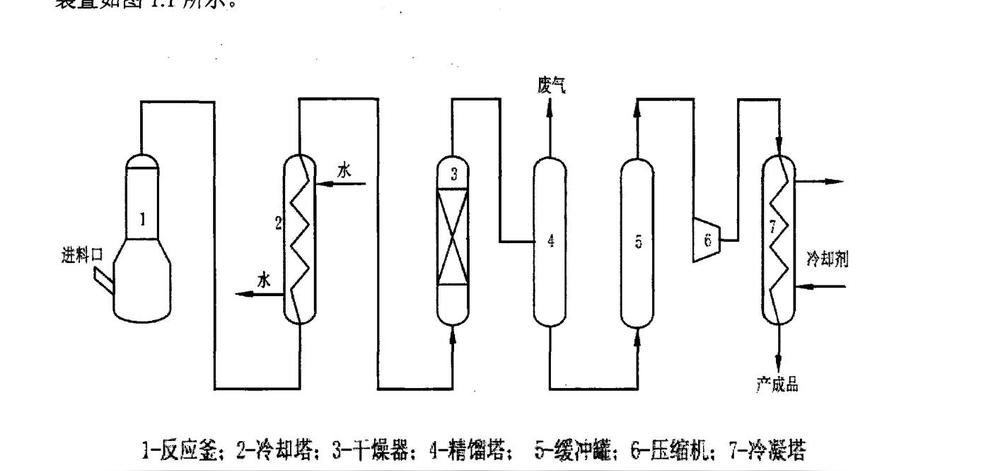
实验室硝酸铵分解制一氧化二氮流程图
(2)工业化生产法工业化生产方法通常采用如下几种方法:
①硝酸铵热分解法
反应原理:该反应为放热反应,反应后产物中主要杂质有NO、NO2和NH3,由原料带入的杂质有CO2、Cl2等。反应生产物中酸性杂质用NaOH除去:

生成的NaNO2及生成的还原性杂质用高锰酸钾水溶液氧化除去,通过碱塔后N2O中夹带有微量碱液,通过酸洗、中和除去。
②氨的接触氧化法
基本原理:氨与氧的混合气在催化剂存在加氧化生成N2O:

氨氧化法制一氧化二氮,粗略看该流程与氨氧化制一氧化氮、二氧化氮的流程一样,主要是控制温度和供氧量。如果控制得好,反应生成物主要是一氧化二氮,还有少量一氧化氮和二氧化氮。经高压水洗、干燥后再经过低温精馏得到一氧化二氮[2]。
医学领域一氧化二氮有麻醉镇痛效果,因此其被广泛应用在牙科、产科等领域。临床应用的笑气是由50%氧化亚氮与50%氧气混合而成,为无色、有甜味的惰性无机合体,化学性能稳定,不易燃烧爆炸,通过抑制中枢神经系统神经递质的释放和神经冲动的传导及改变离子通道的通透性而产生药理作用,对呼吸道无刺激,与血红蛋白不结合,对心、肝、肾等无不良影响。此外也有医师认为笑气是一种较理想的分娩镇痛气体,因为笑气吸入后显效快,30~50秒会产生镇痛作用,分娩后作用消失,镇痛效果好,副反应小,对孕妇和胎儿安全率高,并且易被产妇接受[5]。
食品工业蔬果保鲜
有研究报道N2O处理可以延长顽拗型种子——荔枝和龙眼种子的储藏寿命,还可抑制番茄果实乙烯产生,减少一些跃变和非跃变型果实腐烂发生。提高香蕉的保鲜效果,降低香蕉冠腐病的发生率[5]。
食品加工
一氧化二氮在食品工业中也被推广使用,常作为奶油发泡剂或混合剂。用于奶油发泡的一氧化二氮,是目前滥用一氧化二氮的主要来源[3]。
航空航天由于笑气既不会燃烧也无毒,是一种助燃剂,在航天技术方面,笑气的用处将相当广泛,它不仅可以用于固液发动机,还可以用于冷气推进、单组元推进、双组元推进和电热推进,推力从毫牛级到牛顿级以至千牛级;最初是用在帮助二战时德军飞机迅速逃离战场。
因为笑气的分解产物是氧气和氮气,将氧气收集起来,可以供航天员使用,因此,笑气还可以作为飞船的氧源;同时,液态笑气转变为气态时会吸收大量热量,也可以作为飞船的冷源。
美国spacedev公司曾建造了首艘私营亚轨道载人飞船“太空船一号”,该飞船采用一氧化二氮和橡胶作为其固液混合推进系统的燃料,2004年在一周内两次飞入太空,从而开创了载人航天采用无毒安全推进剂的历史,由此赢得了1000万美元的“安萨里X奖”。
美国内华达山脉公司正在研制一种名为追梦者的新型的载人飞行器,这种飞行器可能具备垂直起飞,水平着陆的能力,在发射时,飞船将绑在发射台上一个大型火箭助推器上。“追梦者”飞船不使用低温液氢或含氧燃料,相反,它将使用燃烧液态一氧化二氮(笑气)氧化剂和固体橡胶燃料固液混合火箭。
汽车系统氮气加速系统是由美国HOLLEY公司开发的产品。在目前世界直线加速赛中,为了在瞬间提高发动机功率,利用的液态氮氧化物系统正是NOS,NOS是以一氧化二氮灌入引擎后提升爆发力的,二次世界大战期间德国空军使用的就是NOS,战争结束后才逐渐被用于民用汽车的改装上。使用氮氧加速系统的改装车辆将一氧化二氮送入引擎,遇热分解成氮气和氧气,提高引擎燃烧率,增加速度。氧气有助燃作用,加快燃料燃烧。
气体危害
健康影响5569次播放00:55让你笑不停的“笑气”,最后让你哭都来不及!必须远离!2162次播放03:06切勿滥用笑气:轻则损伤神经,重则危及性命一氧化二氮是一种无毒、无色、不可燃的储存于钢瓶中的液化压缩气体。其存储压力为其蒸汽压。当空气中一氧化二氮含量过高而使空气中氧含量低于19.5%时,会导致快速窒息,这时需配备自给式呼吸器(SCBA)。它是一种氧化剂,支持燃烧,剧烈助燃。误用一氧化二氮会由于缺氧而死亡。滥用一氧化二氮会影响人的判断和行动的能力[10]。
急性潜在健康影响:
暴露途径:
眼睛接触:接触正在蒸发的液体会引起组织冻伤。
吸入:简单室息剂。
皮肤接触:接触正在蒸发的液体会引起冻伤和冻疮。
多次暴露的潜在健康影响:
进入路径:吸入
损害器官:无
症状:如果人员处于含氧量不足(在19.5%以下)的空气中,会引起眩晕、疲劳、恶心、呕吐、唾液过多,反应迟钝,失去知觉甚至死亡。如果人员处于含有8一10%或更少的氧含量的空气中,将会无任何先兆地失去知觉,失去自我救护及保护的能力。长期暴露在一氧化二氮中还会有其它的影响。它被证明与神经科疾病有很大关系。症状包括:手脚麻木或刺痛、手指失去感觉、平衡性下降、肌肉萎缩。它还被怀疑使人更易感染流行病。虽然还没有确认,但应尽量避免接触它[10]。
温室效应联合国环境规划署在11月21日发布的一份题为《削减一氧化二氮排放保护臭氧层和缓解气候变化》(Drawing Down N2O to Protect Climate and the Ozone Layer)的报告中指出,一氧化二氮可严重消耗臭氧层物质并产生温室效应,其危害在同类物质中排名第三。如不采取任何行动,到2050年其浓度或将平均增加83%。因此,国际社会必须下定决心并做出承诺,采取尽可能的行动削减一氧化二氮的排放。
根据报告,农业是一氧化二氮人为排放的最大来源,占全部排放的三分之二,而其他主要的一氧化二氮排放源包括工业和化石燃料燃烧、生物质燃烧和废水等。
报告指出,以往,大气中自然存在的一氧化二氮数量甚微,但工业革命以来人类活动加剧了这一气体在大气层中浓度的增长。由于一氧化二氮的排放与很多经济部门相关,采取减排措施将无可避免地增加这些部门的生产成本,但与此同时,取得的收益将包括提高农作物和畜牧业产量、减轻贫困、改善人类健康和减少环境退化等,其效益预计可高达1600亿美元。
报告还列举了一些在工农业等领域减少一氧化二氮排放的具体措施。例如,减少过多肉类消费及食物浪费和损失、控制己二酸和硝酸的排放、提高炉灶的燃料和燃烧效率、降低废水排放中的氮含量、提高氮肥利用率等。
环境署执行主任施泰纳表示,虽然一氧化二氮不像二氧化碳那样大量、普遍地存在于大气中,但是因为一氧化二氮的辐射性和长达120年的寿命,它不仅会破坏臭氧层,同时也会对全球变暖造成影响。减少一氧化二氮的排放,将可为实现将全球变暖控制在2℃的目标提供另一个契机[6]。
气体滥用吸食“笑气”能让人在生理和心理上产生依赖,但“笑气”不属于毒品,也未列入《麻醉药品及精神药品品种目录》。目前很多全世界各地均出现了“笑气”吸食现象,且吸食人群不断蔓延扩大,危害巨大。以2017~2019年杭州市的情况为例,涉“笑气”警情反馈数分别为104次、194次和703次,几乎呈几何级数式增长[8]。同时,笑气的吸食滥用正在年少青群体迅速蔓延,相关人群以90后、00后群体为主、占8成比例。此外“笑气”分装贩售活动已形成完整而高效的黑色产业链。由于其不在管制药品范围内,现行的法律法规便无法对生产、运输、销售、持有“笑气”的行为进行更有效的规制和打击。鉴于其具有的被滥用趋势和巨大现实危害性,有专家认为,应有针对性地将其纳入社会综合性治理体系[7]。
安全措施
紧急救助眼接触:接触液体或冷的蒸汽会引起组织冻结。轻柔地用温水洗眼,并立即进行医务处理。
吸入:将其移到空气清新处,若停止呼吸,采用人工呼吸,若呼吸困难,则输氧,并迅速进行医务处理。
皮肤接触:接触液体或冷的蒸汽会引起组织冻疮。用温水(<105F)给受伤部位升温。[10]。
意外泄漏撤离立即受影响的区域。如果泄漏较小,则对该区域加强通风或将钢瓶移到室外。如果泄漏较大,将所有人员撤离受影响的区域。对泄漏区域加强通风并检测氧气含量。视泄漏的大小,如有可能,切断气源并将泄漏的钢瓶隔离。若从容器内及泄压阀或其他阀门泄漏,则需与供应商联系。若泄漏来自用户系统,关掉钢瓶阀门,在修复前一定要泄压并用惰性气体吹扫。
火灾爆炸一氧化二氮不可燃,但可助燃。所以需要注意其周围的火情。
特殊灭火指导:
从泄漏区疏散所有人。如果可能,从火场移走一氧化二氮钢瓶或用水冷却。如有必要,营救人员需用自给式呼吸器。异常火灾和爆炸危害:
氧化剂,强烈助燃。一些物质在空气中不燃烧,但在有氧化剂时会燃烧。当它和可燃性物质混合后会形成爆炸性物质。如:油、油脂或其它碳氢化合物。在火焰或热量的作用下,钢瓶会剧烈的排空和/或猛烈的爆炸。大部分气瓶设计了温度升高时的泄压装置。由于热量的作用钢瓶内压力会升高,如果泄压装置失灵会引起钢瓶爆炸[10]。储存使用
206次播放01:27笑气麻醉的优点110次播放04:07什么是笑气?孩子看牙时可以用吗?储存:
在通风良好、安全且不受天气影响的地方存储。钢瓶应直立摆放。对于还未使用的气瓶应保持阀盖和输出阀的密封完好。存储温度不可高于125F(52℃),存储区域应远离频繁出入处和紧急出口。区域内不应有盐或其它腐蚀性物质。将空瓶与满瓶分开储存。避免过量存储和存储时间过长。使用先进先出系统以防满瓶储存时间过长。每周至少目测一次储存的钢瓶,检查是否有泄漏或其它问题。注意:
因为它是“笑气”,有麻醉作用。应该防盗和防止误用。它的钢瓶应储存在控制区域。使用者必须意识到浓度过高造成的危害,特别是在有限空间内。遵守0SHA的规定,特别是29CFR1910.1469(进入有限空间)的规定.使用:
一定不要拉、滚动或滑动钢瓶。用合适的手推车来移动容器,不要试图抓住气瓶的盖子来拎起它。保证气瓶在使用的全过程中为固定状态。用一个减压调节阀或独立的控制阀安全地从气瓶内释放气体。用单向阀来防止倒流回钢瓶。使用合理的管线及设备适用需要的压力。不要用明火或其他附近的热源加热钢瓶的任何部分。一旦钢瓶与管线接好,应仔细地,缓慢地打开阀门。如果使用者在操作气瓶阀时有困难,需停止使用,并与供应商联系。不可将工具(如:扳手,螺丝刀,等)插入阀帽内。否则会损坏阀门并引起泄漏。使用可调节的带扳手来打开过紧或生锈的阀帽[10]。监测方法
目前测定N2O的方法有气相色谱一氨离子化检测器(CHD)B4、气相色谱一电子捕获法(GC ECD)、大气压离子质谱法圆等,这些方法大多测定以N2O组分为主或N2O色谱保留时间与其它气体成分的保留时间相差较大的气体中N2O含量[9]。
管理信息
操作的管理:密闭操作,提供良好的自然通风条件。操作人员必须经过专门培训,严格遵守操作规程。远离火种、热源,工作场所严禁吸烟。远离易燃、可燃物。防止气体泄漏到工作场所空气中。避免与还原剂接触。搬运时轻装轻卸,防止钢瓶及附件破损。配备相应品种和数量的消防器材及泄漏应急处理设备。
储存的管理:储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。应与易(可)燃物、还原剂分开存放,切忌混储。储区应备有泄漏应急处理设备。
运输的管理:采用钢瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物、还原剂等混装、混运。夏季应早晚运输,防止日光曝晒。铁路运输时要禁止溜放。
废弃的管理:处置前应参阅国家和地方有关法规。废气直接排入大气。
环境效应
在环境科学研究中,特别是在全球气候变化领域(Global Climate Change),N2O通常被称为氧化亚氮,是一种温室气体(Greenhouse Gas),具有温室效应(Greenhouse Effect),加剧全球变暖(Global Warming),是《京都议定书》规定的6种温室气体之一。N2O在大气中的存留时间长,并可输送到平流层,导致臭氧层破坏,引起臭氧空洞,使人类和其它生物暴露在太阳紫外线的辐射下,对人体皮肤、眼睛、免疫系统造成损害。
与二氧化碳相比,虽然N2O在大气中的含量很低,属于痕量气体(trace gas)但其单分子增温潜势却是二氧化碳的298倍(IPCC,2007);对全球气候的增温效应在未来将越来越显著,N2O浓度的增加,已引起科学家的极大关注。对这一问题的研究,正在深入进行。
大气N2O的重要来源之一是农田生态系统,在土壤中,N2O是由硝化、反硝化微生物产生,人们向农田中施入过量氮肥,促进微生物活动,通过硝化、反硝化过程(nitrification and denitrification)使氮素转化为N2O。污水生物脱氮硝化和反硝化过程也会引起氧化亚氮的排放,溶解氧的限制、亚硝酸盐的积累和羟胺的氧化都是导致氧化亚氮产生的原因。