理化性质
三氟化氯分子式为ClF3,分子量为92.45,无色气体或绿色液体,沸点为11.3℃,熔点为-76.3℃,相对密度为3.14(空气=1)。有毒,有很强腐蚀性。

三氟化氯
拉夫(Ruff)和克鲁格(Krug)在1930年制成氟化氯并报告发现了这种物质。这个反应也生成一氟化氯,可以通过蒸馏使其分离。
3 F2+ Cl2→ 2 ClF3
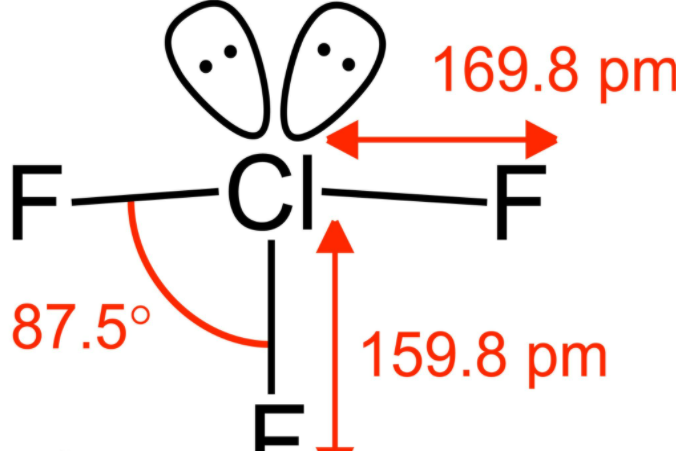
ClF3形状大致是T形, 有一个短键(1.598Å)和两个长键(1.698Å),孤对电子占据两个赤道位置,与共价键一起形成一个三角双锥,这种结构与价层电子对互斥理论的预测一致,较长的Cl-F键与超价键一致。
纯净的ClF3在180℃以下的玻璃容器中是稳定的,一旦超过这个温度就会通过自由基反应分解。
稳定性:是已知最活泼的化合物之一。立即侵蚀玻璃,有湿气时也腐蚀石英,与水剧烈反应而爆炸,与有机物反应有火光发生。
用途
(1)ClF3主要用来生产六氟化铀(UF6),以及核燃料加工和后期处理,主要反应方程式:
U + 3 ClF3→ UF6+ 3 ClF
(2)在半导体工业中,三氟化氯被用于清洁化学气相沉积的反应舱。它具有不需拆卸反应舱就可以清除舱壁附着的半导体物质这一优点。与其它代替的清洁剂不同,三氟化氯在使用前不需经过等离子体激化,因为反应舱残存的热量就足以使它分解并与半导体材料反应。
合成方法
制备原理:Cl2+3F2=2ClF3
装置与制ClF相同,可以不用液态氧冷却的阱,反应炉加热到230℃。氯气流缓慢一些,如果F2对于Cl2比例太小则主要形成ClF,且ClF3中含有较多的Cl2。
氟化完毕后,把用干冰冷却的气阱中凝集的液态ClF3倾入一个用干冰冷却的钢瓶中并立刻关紧。当钢瓶温度升至室温时,连上压力计打开阀门,使气体放出直至0.122MPa为止。此时ClF、Cl2、F2均挥发逸出。收率随Cl2∶F2的值而定,一般可达60%~85%。
环境影响
健康危害侵入途径:吸入。
健康危害:对皮肤、粘膜有刺激作用。
毒理学及环境急性毒性:LC50299ppm,1小时(大鼠吸入);178ppm,1小时(小鼠吸入)
危险特性:若遇高热,容器内压增大,有开裂和爆炸的危险。
燃烧(分解)产物:氟化氢、氯化氢。
监测方法
气相色谱法,参照《分析化学手册》(第四分册,色谱分析),化学工业出版社。
环境标准
前苏联(1975) 作业环境空气中有害物质的允许浓度 0.4mg/m。
应急处理
泄漏处理迅速撤离泄漏污染区人员至上风处,并隔离直至气体散尽。切断火源。建议应急处理人员戴自给正压式呼吸器,穿厂商特别推荐的化学防护服(完全隔离)。切断气源。喷氨水或其它稀碱液中和,注意收集并处理废水。然后抽排(室内)或强力通风(室外)。如有可能,将残余气或漏出气用排风机送至水洗 塔或与塔相连的通风橱内。漏气容器不能再用,且要经过技术处理以清除可能剩下的气体。
防护措施呼吸系统防护:空气中浓度超标时,必须佩戴防毒面具。紧急事态抢救或逃生时,建议佩带正压自给式呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿相应的防护服。
手防护:戴防化学品手套。
其它:工作现场禁止吸烟、进食和饮水。工作后,淋浴更衣。进入罐或其它高浓度区作业,须有人监护。
急救措施皮肤接触:脱去污染的衣着,立即用流动清水彻底冲洗。若有冻伤,就医治疗。
眼睛接触:立即提起眼睑,用流动清水或生理盐水冲洗至少15分钟。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。呼吸困难时给输氧。呼吸停止时,立即进行人工呼吸。就医。
灭火方法:不燃。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷处。雾状水。
制备结构
氯氟化物
拉夫(Ruff)和克鲁格(Krug)在试图氟化氯后最早报道了这种物质,这个反应也产生一氟化氯,可以通过蒸馏使其分离。
3 F+ Cl→ 2 ClF ClF形状大致是T形, 有一个短键 (1.598 Å) 和两个长键 (1.698 Å).这种结构与价层电子对互斥理论的预测一致——孤对电子占据两个赤道位置,与共价键一起形成一个三角双锥. 拉长的Cl-F键与超价键一致。
纯净的ClF在180℃以下的玻璃容器中是稳定的,一旦超过这个温度就会通过自由基反应分解。
ClF主要用来生产六氟化铀(UF),以及核燃料加工和后期处理,主要反应方程式:
U + 3 ClF→ UF+ 3 ClF。
危害
ClF3是一种很强氧化剂和氟化剂。它能大多数有机和无机材料甚至塑料反应,可以使许多材料不接触火源就燃烧。这些反应通常很剧烈,在某些情况下甚至会爆炸。它与一些金属反应生成氯化物和氟化物,与磷反应生成三氯化磷和五氟化磷,而与硫反应生成二氯化硫和四氟化硫。 ClF3也与水剧烈反应,水解产生有毒物质,例如氟化氢。H2S在室温下与ClF3混合就会爆炸。
能够超越氧气的氧化能力导致对含氧材料的腐蚀性,这些材料通常被认为不可燃的. 在一工业意外中, 900 kg ClF3泄漏把自身烧通30厘米的混凝土和90厘米的砾石。任何和三氟化氯接触的设备,必须仔细挑选和清洁, 因为任何污染可以点燃接触物。
安全信息
危险品标志:腐蚀
安全标识:S17S38
危险标识:R6R38R41
危险品运输编号:1749
计算化学数据
1、疏水参数计算参考值(XlogP):2.5
2、氢键供体数量:0
3、氢键受体数量:3
4、可旋转化学键数量:0
5、互变异构体数量:无
6、拓扑分子极性表面积:0
7、重原子数量:4
8、表面电荷:0
9、复杂度:8
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1