晶体场理论是研究过渡族元素(络合物)化学键的理论。它在静电理论的基础上,结合量子力学和群论(研究物质对称的理论)的一些观点,来解释过渡族元素和镧系元素的物理和化学性质,着重研究配位体对中心离子的d轨道和f轨道的影响。
晶体场理论相关的文章
阿拉伯语(阿拉伯语:لغة عربية ),即阿拉伯人的语言,属于亚洲语系闪米特语族内的西南语支,是中东地区阿拉伯国家联盟22个成员国的官方语言,也是全世界八亿多穆斯林的宗教语言,更是世界诸多国际会议必备的工作语言之一。1974年,阿拉伯语被列为联合国的第六种工作语言。以它为母语的人口达2亿多,全
法国大革命(法语:La Révolution Française,英语:The French Revolution)是法国发生激进政治和社会变革的时期,始于1789年的三级会议,结束于1799年11月法国领事馆的成立。法国大革命是法国人民反抗君主专制和阶级特权的一场革命。“自由、平等、博爱”是革命的
甜瓜(学名:Cucumis melo L.)是葫芦科(Cucurbitaceae)黄瓜属(Cucumis)植物,别名白兰瓜、哈密瓜、香瓜。甜瓜原产于印度和非洲国家,后广泛引种于世界温带至热带地区,中国各地广泛栽培。甜瓜喜光照,喜温耐热,常生长在土层深厚、通透性好、不易积水的沙土中。
阿尔泰山脉(英语:Altai Mountains;俄语:Алтай),是位于欧亚大陆中部的山系,坐落在北纬45°~52°,东经84°~99°之间,地跨哈萨克斯坦、俄罗斯、中国和蒙古四国,整体呈西北-东南走向。其东北与萨彦岭相连,随后地势向东南逐渐变低,并与戈壁沙漠相接。该山脉东西总长约2000千米,
安西都护府和安西大都护府是唐朝管理碛西的一个军政机构的不同时期的名称,其统辖安西四镇,最大管辖范围曾一度完全包括天山南北,并至葱岭以西至达波斯,在武周时期北庭都护府分立之后,安西都护府分管天山以南的西域地区。
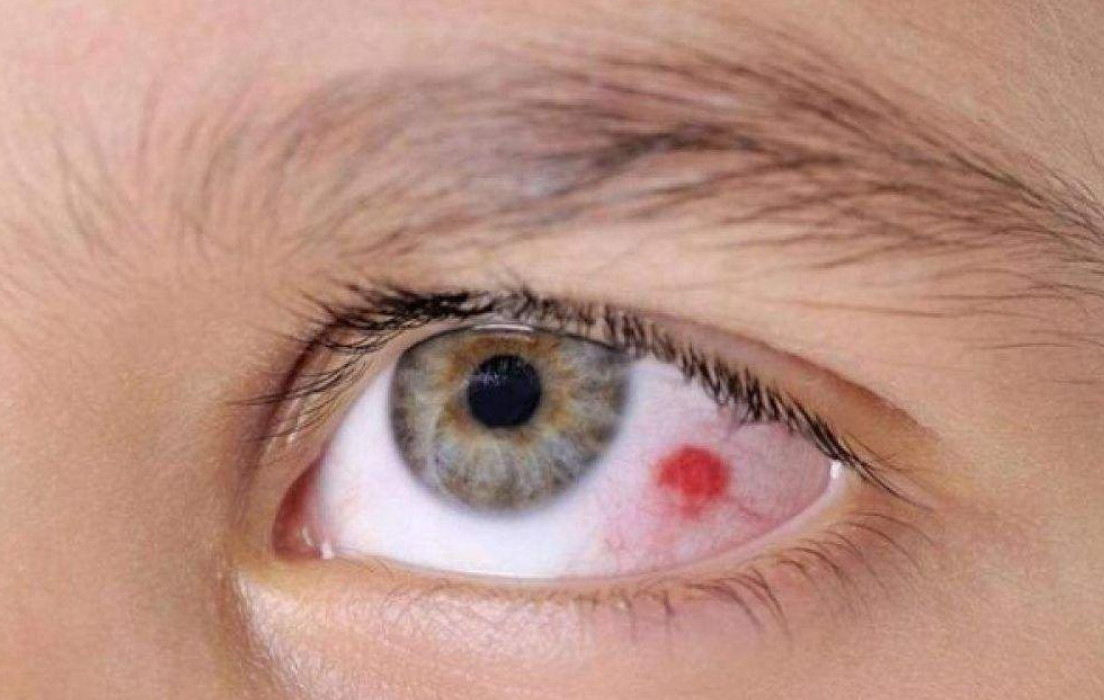
眼底出血是一种由视网膜病变和本身病变而引起的一种疾病。眼底出血不是一种独立的眼病,而是许多眼病和某些全身疾病所共有的特征。全身性血管、血液性病变都可以从视网膜及其血管反应出来,同时也可直接引起视网膜的出血性病变。[1]

尚可名片
这家伙太懒了,什么都没写!