介绍
杂交瘤抗体技术的基本原理是通过融合两种细胞而同时保持两者的主要特征。这两种细胞分别是经抗原免疫的小鼠细胞与小鼠骨髓瘤细胞。脾淋巴细胞的主要特征是它的抗体分泌功能和能够在选择培养基中生长,小鼠骨髓瘤细胞则可在培养条件下无限分裂、增殖,即所谓永生性。在选择培养基的作用下,只有b细胞与骨髓瘤细胞融合的杂交细胞才具有持续增殖的能力,形成同时具备抗体分泌功能和保持细胞永生性两种特征的细胞,这种杂种细胞叫做杂交瘤细胞。
制作方法
制备1)瘤细胞培养(无特殊要求)
骨髓瘤细胞呈悬浮或轻微附着形式生长,如附着性生长的细胞多时,用吸管轻轻吹打或轻轻叩击培养容器即可分离下来。通常要维持细胞于指数生长期(细胞培养时间为15~20小时),56每3~5天取细胞0.2~1ml移入到10ml新培养液中,其最大细胞密度不能超过5×10~10/ml。一般使用含有高糖的DMEM培养液,并补加有pH的稳定剂HEPES。
2)免疫小鼠和脾细胞的制备
免疫小鼠:取6~8周龄Balb/C雌鼠,基础免疫2周,静脉再加强免疫一次,3~5天后用于融合。
脾细胞制备:1.引颈处死小鼠,用酒精消毒表体。
2.无菌条件下取出脾脏,剃除结缔组织和脂肪,用5ml无血清培养液冲洗一次。
3.把脾脏置于已消毒的90~100目不锈钢网或尼龙纱网中。
4.在脾中部切开一小口,用注射器芯从一端轻轻压挤,再用无血清培养液冲洗,令细胞通过纱网,收集入平皿中,或用注射器向脾脏内注入3ml无血清培养液,反复抽吸数次方法获取细胞,再制成细胞悬液亦可。
5.把细胞悬液注入50ml离心管中,加10~20ml培养液,轻轻吹打数次,室温中置5分钟。
6.离心(800~1000转/分)计数,备用。
3)饲细胞的制备:常用小鼠胸腺细胞或小鼠的腹腔细胞
饲细胞的制备:
小鼠腹腔细胞制备方法:
1.引颈处死小鼠,用酒精消毒表体。
2.切开腹部皮肤剥向两侧,暴露出腹壁。
3.用无菌7号针头注射器,吸取3ml无血清培养液。
4.用小镊夹起腹壁,注入3ml无血清培养液,用手反复轻轻揉腹壁,再反复抽吸3~5次。
5.收集末次吸得的细胞,注入50ml的离心管中,再加20ml无血清培养液,用吸管漂洗一次。
6.离心,去上清,用含血清培养基调节细胞浓度为2×105/ml,接种入培养板中,24孔板每孔加0.1ml。
4)细胞融合
HAT培养基的制备[贮备液成分]100×次黄嘌呤(Hypoxanthine:H)胸腺嘧啶核苷(Thymidine:T)氨基喋呤(Amiropterin:A)[HT贮备液制备贮备液制备]
1.称取136.1mgH,38.8mgT。
2.依次溶解在100ml双蒸水中,H难溶,可加温50~80℃促溶。
3.用0.22微米滤膜滤过除菌,每瓶分装2~5ml,-20℃冰箱贮存。
[A贮备液制备贮备液制备]
1.称取17.6mgA到90ml双蒸水中。
2.滴加1MNaOH溶液并不断摇动,直至完全溶解,再滴加等量1MHCl溶液,恢复pH在7.0左右。3.补足双蒸水至最终体积100ml。
4.0.22微米滤膜滤过除菌,分装,-20℃冰箱贮存。使用时,每100ml培养液(含血清)加1mlHT贮备液和1mlA贮备液。1.0×10-2M1.6×10-3M4.0×10-5MPEG(诱导剂)的制备(30%~50%)
1.取分子量1000的PEG高压蒸气灭菌(6.8公斤,15分钟)
2.56℃水浴中融化后,37℃水浴中温浴。
3.取无血清培养液37℃水浴中温浴(单独)
4.配40%浓度时,用刻度吸管吸0.4mlPEG和0.6ml无血清培养液混合、37℃水中温育备用。
细胞准备
1.收集骨髓瘤细胞,用无血清培养液洗3次(37℃),计数活力细胞(不少于90%)。
2.收集小鼠脾细胞,用无血清培养液洗3次(37℃),并计细胞数和测定活力细胞。
3.按1:5或1:10混合脾细胞和骨髓瘤细胞后,离心弃去上清,并以消毒滤纸吸净多余上清。
融合方法一:
1.将1ml40%的PEG液一滴滴加入到细胞团中,在60秒内加完,同时并不断轻微转动离心管或用手指轻弹离心管。
2.在不断转动离心管中加1ml无血清培养液,60秒钟内加完。
3.于5分钟内慢慢加完20ml无血清培养基。此时细胞对机械损伤非常敏感。
4.离心(800转/分,8分钟),去上清,用完全培养液10ml悬浮,轻轻混匀。
5.取96孔板,每孔加50微升。
6.取等体积细胞悬液,向另一96孔板中加50微升。
7.送入5%CO2温箱中37℃培养,24小时后更换成HAT选择性培养液。
方法二:
1.加0.2ml43%的PEG于离心管中。
2.用预先消毒的细玻璃针伸入管中轻轻搅动细胞团。
3.室温中置2分钟。
4.加入10ml完全培养液。
5.800转/分离心5分钟。
6.2倍HAT培养液培养悬浮细胞,24孔板,用取每孔中加0.5ml,96孔板每孔中加0.1ml。另7.5%CO2温箱,37℃,一周后第一次更换培养液,培养板中预先接种有饲养细胞,加2×HAT选择培养液与原等量培养液混合后,即成为1×的HAT培养基。
融合后细胞培养
1.融合后7~10天用HAT培养液变量换液,以后每隔2~3天半量换液一次。
2.两周后可改用HT培养液半量换液,或仍用HAT培养液。
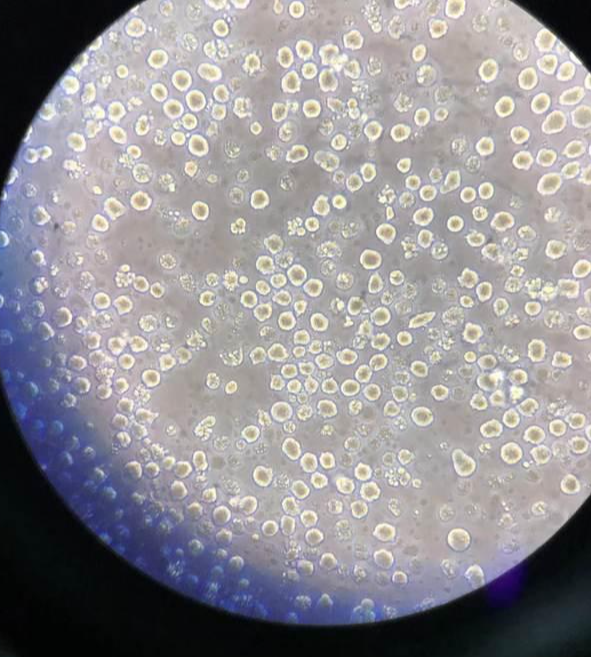
3.2~3周后出现杂交细胞集落,细胞个大,圆且透明。
4.待集落增殖生长至1/3孔时,应进行抗体检测。
克隆化培养[软琼脂培养]
1.称1g琼脂粉,加入到100ml双蒸水中,高压蒸气灭菌,4℃冰箱保存。
2.使用前,1%的琼脂和2×的DMEM培养液在45℃水浴中分别温浴。
3.二者等体积混合后,立即加入1.5×107小鼠脾细胞,混匀。
4.立即到入平皿中,每平皿(直径10cm)加10ml,室温中置15分钟。
5.另取杂交瘤细胞悬液和0.5%琼脂等体积混合(0.25%琼脂),加2ml到预先铺有底层琼脂的瓶皿内。
6.CO2温箱培养。
7.10~15天后,有细胞集落形成,适时移入24孔培养板中扩大培养。如用琼脂糖,底层浓度为0.6%,上层为0.3%琼脂。
[有限稀释法]
1.制备有饲养细胞底层的细胞培养板。
2.收集细胞、计数阳性培养细胞。
3.细胞悬液调至5~10个细胞/ml。
4.96孔板中每孔加0.1ml。
5.CO2温箱培养一周后,半量换液,继续培养。
6.适时检测每孔培养上清,挑选呈阳性培养孔的细胞继续进行有限稀释,直至确信孔中细胞为单克隆为止。
7.进行扩大培养。
5)抗体的检测)常用方法:免疫荧光试验、放射免疫试验(RIA),酶联免疫吸附试验(ELISA)等。胞的筛选
实验方法ELISA法。首次检测时间在细胞融合后10天左右进行。
ELISA法所需试剂配置
包被缓冲液(pH9.60.05M碳酸盐缓冲液):
Na2CO31.59g
NaHCO3 2.93g
加蒸馏水至1000ml
洗涤缓冲液(pH7.40.15MPBS):
KH2PO4 0.2g
Na2HPO4·12H2O 2.9g
NaCl 8.0g
KCl 0.2g
Tween-20 0.05% 0.5ml
加蒸馏水至1000ml
操作步骤包被抗原:pH9.6碳酸盐缓冲液(CBS)稀释抗原,加入到酶标板中,100μL/孔,37℃2小时或4℃过夜。甩干,洗涤3次,3分钟/次。
封闭(血清或脱脂奶粉):此步有时用,有时不用。
加被检样品(一抗),100μL/孔,37℃半小时,甩干,洗涤3次,3分钟/次。
加酶标抗体(二抗),100μL/孔,37℃半小时,甩干,洗涤3次,3分钟/次。
显色:5ml的显色A液,5ml的显色B液,100μL/孔,37℃反应10~20分钟。
终止反应:加2MH2SO4,50μL/孔。
结果判定。肉眼或用酶标仪在450nm波长下测定OD值。
本实验室目前采用洗板机进行洗涤。