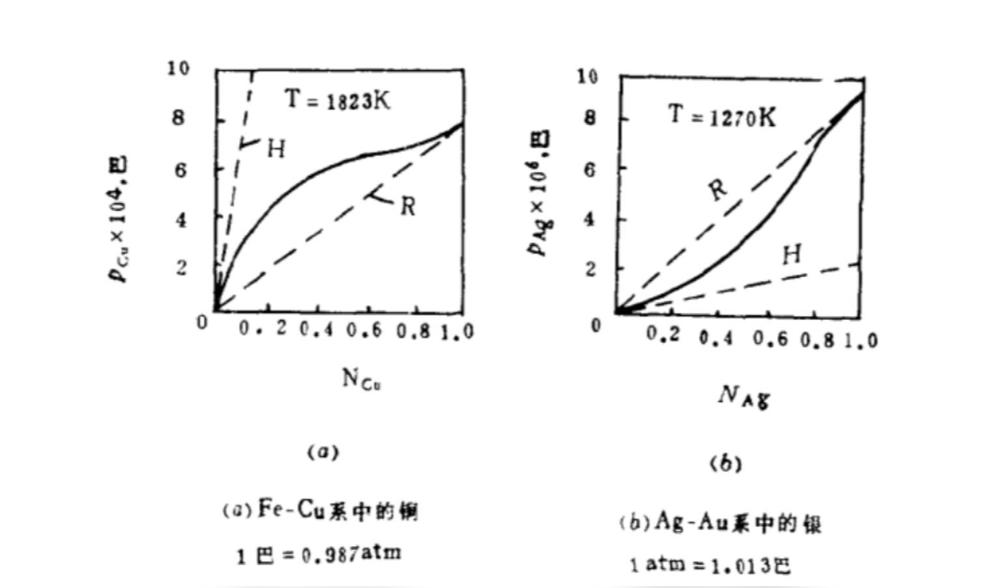
实际溶液是实际存在的溶液,实际溶液的溶剂不遵守拉乌尔定律,溶质也不遵守亨利定律。
精选百科
本文由作者推荐
实际溶液相关的文章
小编整理:孟广美(MengGuangmei),1967年12月1日出生于中国台湾省,中国台湾女演员、模特、主持人。-1985年,十八岁的孟广美到意大利念书,从事先修班,随后进入米兰模特学校就读。-1995年,进入演艺圈发展,参演的首部电影为意大利艾米利亚罗马涅
香港天文台(简称天文台;英语:Hong Kong Observatory,简称HKO)是商务及经济发展局(前经济发展及劳工局)辖下的部门,也是世界气象组织成员,专责香港的气象观测、地震、授时、天文及辐射监测等工作,并向香港公众发出相关的警告。现任天文台台长为岑智明。
阿拉伯语(阿拉伯语:لغة عربية ),即阿拉伯人的语言,属于亚洲语系闪米特语族内的西南语支,是中东地区阿拉伯国家联盟22个成员国的官方语言,也是全世界八亿多穆斯林的宗教语言,更是世界诸多国际会议必备的工作语言之一。1974年,阿拉伯语被列为联合国的第六种工作语言。以它为母语的人口达2亿多,全
偏头痛本词条是多义词,共2个义项原发性头痛类型偏头痛(migraine)是临床最常见的原发性头痛类型,临床以发作性中重度、搏动样头痛为主要表现,头痛多为偏侧,一般持续4~72小时,可伴有恶心、呕吐,光、声刺激或日常活动均可加重头痛,安静环境、休息可缓解头痛。偏头痛是一种常见的慢性神经血管性疾患,多起病于儿童和青春期,中青年期达发病高峰,女性多见,男女患者比例约为1∶2~3,人群中患病率为5%~10

尚可名片
这家伙太懒了,什么都没写!
作者