理想溶液 ideal solution(s)溶液中的任一组分在全部浓度范围内都符合拉乌尔定律的溶液称为理想溶液。 理想溶液忽略不计分子、离子及其他微小质点相 互作用影响的一种溶液。即认为溶质与溶剂混合成为溶液时,既不放热,也不吸热,溶液体积恰为溶质和 溶剂的体积之和。理想溶液是人们假设的溶液,以简化化学计算。
精选百科
本文由作者推荐
理想溶液相关的文章
鸡肉炒饭是一种食物,制作原料主要有鸡肉、米、盐等。焯蔬菜是尤其是绿叶蔬菜时,要在水开后加少许盐和油,蔬菜焯好后马上倒入凉水里冰一下。这样会使绿色蔬菜颜色更好看,味道也好吃。
环颈雉(Phasianus colchicus),别名雉鸡、野鸡、山鸡,雉科雉属鸟类。体长一般为590~870毫米,体重880~1659克。雄鸟体大,羽色随亚种不同而艳丽多变,头侧各具一耳羽簇,面部裸露皮肤呈红色,头颈暗蓝绿色,部分具白色颈圈或仅有痕迹,体羽为斑驳而泛紫光的栗色至金棕色,尾羽长,其上
拉斯维加斯(LasVegas)是美国内华达州最大的城市,也是座享有极高国际声誉的城市。拉斯维加斯建市于1905年5月15日,因位于内华达州的沙漠边缘、边境,所以拉斯维加斯全年高温。
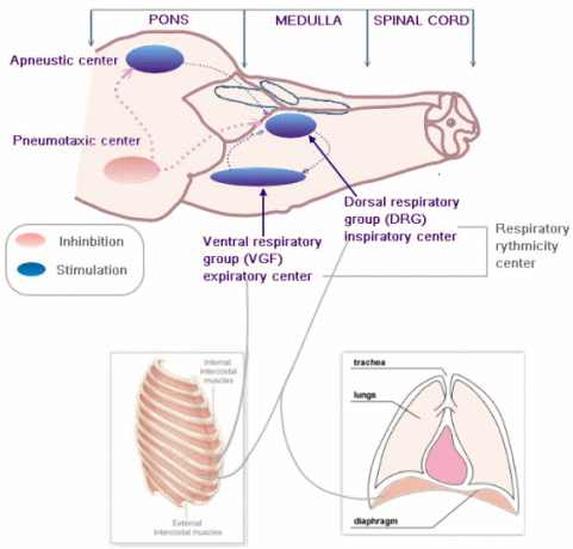
呼吸中枢参与呼吸节律产生调节的细胞群呼吸中枢(respiratory center)是指中枢神经系统内产生呼吸节律和调节呼吸运动的神经细胞群。在对呼吸中枢定位研究的诸多实验中,具有重要价值的是1923年由英国的生理学家拉姆斯登(Lumsden)对猫的脑干进行的分段横切实验。呼吸中枢分布在大脑皮层、间脑、脑桥、延髓和脊髓等各级部位,参与呼吸节律的产生和调节,共同实现机体的正常呼吸运动。延髓呼吸中枢具

尚可名片
这家伙太懒了,什么都没写!
作者