在化学上用,化学物品和溶剂(一般是水)配制成实验需要浓度的溶液的过程就叫做配制溶液。配制溶液前需要计算所需物品的多少并清理仪器。
配制溶液相关的文章
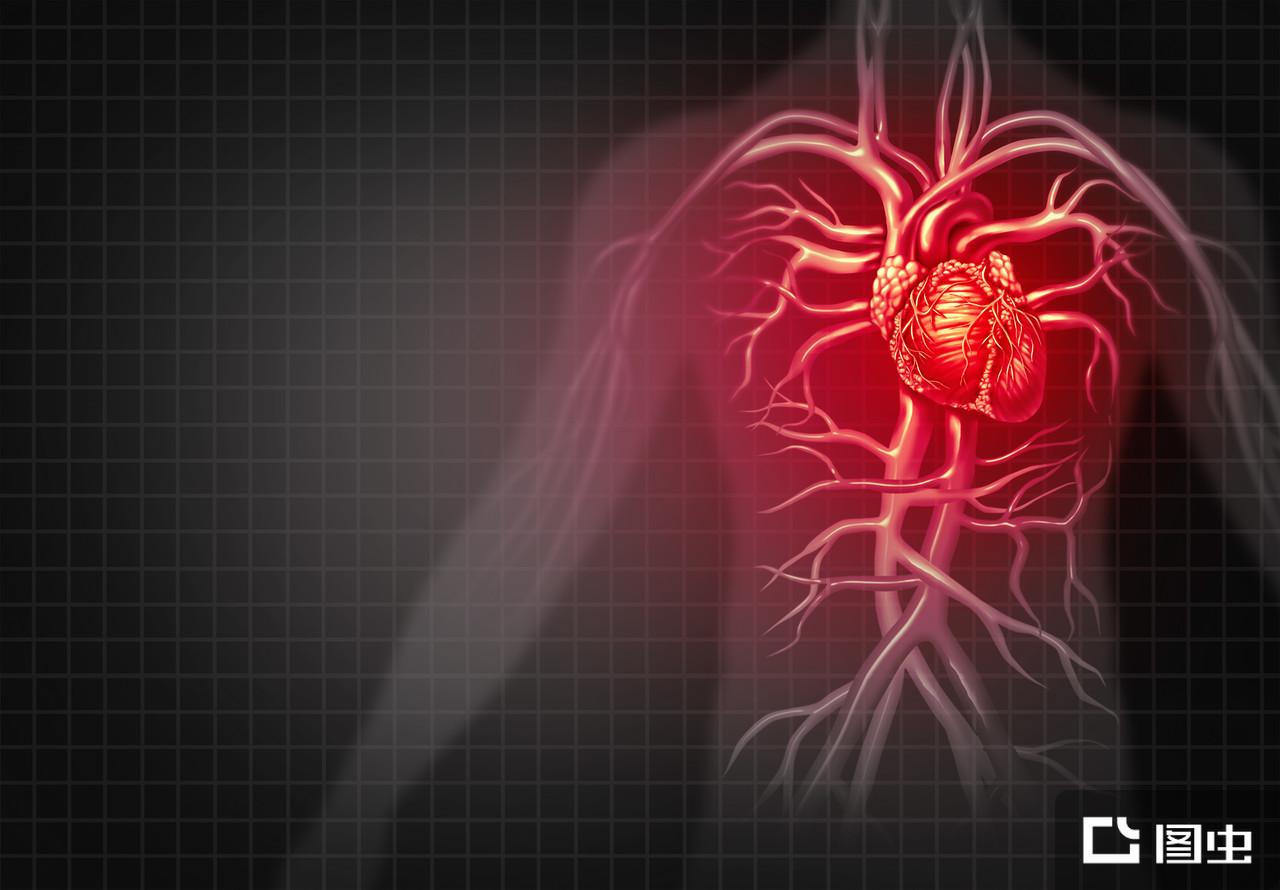
心肌缺血(myocardial ischemia)又称为心脏缺血、缺血性心脏病,是一种心血管内心肌血流量不足引起的病理生理状态。主要是因为供应心肌的冠状动脉因粥样硬化或其他原因而导致冠状动脉血流完全或不完全阻塞,引起冠状动脉供血不足,不能满足心肌代谢需要,心肌消耗其糖原储备进行无氧代谢。长期吸烟或接
世界气象组织(英语全称:World Meteorological Organization,简称:WMO),是联合国的一个专门机构,总部设于瑞士日内瓦,有193个会员国和会员地区(截至2023年6月) ,致力于在地球大气状态和变化规律及其与陆地和海洋的相互作用、大气产生的天气和气候、以及由此产生的水
英国皇家海军,简称为皇家海军(英语:Royal Navy,缩写:RN),是英国的海上作战力量。虽然军舰早在中世纪就被英国国王使用,并投入到百年战争期间的第一场重要海战中。但现代皇家海军起源却要追溯到16世纪初。亦是英国最古老的军种。从17世纪中叶开始,又经历18世纪先后与荷兰、法国争夺过海上霸权。
姜云生本词条是多义词,共2个义项中国区商业银行总经理获北京突出贡献金融人才称号姜云生出生于1973年1月,山东滨州人。1994年毕业于山东工程学院(现山东理工大学),获工学学士。1999年毕业于厦门大学经济系,获经济学硕士。曾于1997-1998年就读于南京大学霍普金斯大学中美文化研究中心。
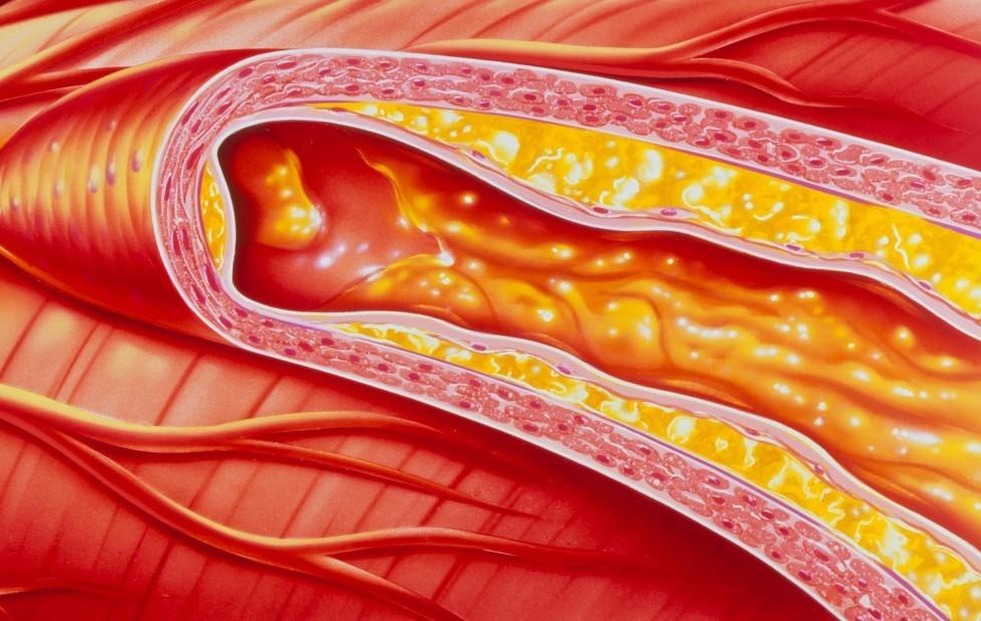
动脉粥样硬化动脉硬化的血管病动脉粥样硬化是一组称为动脉硬化的血管病中最常见、最重要的一种。本病多见于40岁以上的中老年人,男性多于女性。人体中正常的血管是富有弹性的,当血管发生老化、衰退时,血管内脂肪及类脂等物质聚集成斑块,呈黄色粥样,斑块越来越多,会使血管壁增厚变硬,失去弹性,管腔缩小,形成动脉粥样硬化。动脉粥样硬化发生在冠状动脉,则可引起心绞痛、心律失常、心肌梗死;还可发生在脑、肾、下肢动脉,

尚可名片
这家伙太懒了,什么都没写!