非金属性越强相关的文章
梅尼埃病(英文:Ménière Disease,简称MD)又称美尼尔氏病、美尼尔综合征等,简称MD,是一种特发性内耳疾病。其特征是在晕眩发作前、发作期间或发作后,受累耳出现低频至中频传导性听力下降,并伴有波动性听觉症状(听力下降、耳鸣或耳部胀满感)。
鲁霍拉·穆萨维·霍梅尼(1902年9月22日-1989年6月3日),男,伊朗什叶派宗教学者(大阿亚图拉),伊斯兰革命的政治和精神领袖。
朝圣者是指参加朝圣的人们。朝圣者都是朝着他们认为的天堂方向朝拜的,一般都是庙宇和高山等。朝圣者目的地一般为耶路撒冷、麦加或西藏(分属世界三大宗教基督教、伊斯兰教、佛教)。朝圣者有不同的信仰,他们的朝圣之路都是通往他们内心认为的最神圣的地方。朝圣者在朝圣途中有五步一拜、十步一跪的礼仪。有不少朝圣者,在
伊朗伊斯法罕三十三孔桥(Allahver dikhan Bridge、Sio Seh Pol Bridge)(波斯语:سی و سه پل,发音[ˈsiː oˈseh ˈpol],)是伊朗伊斯法罕11座桥梁之一。它被高度评价为萨非桥梁设计最著名的代表之一。
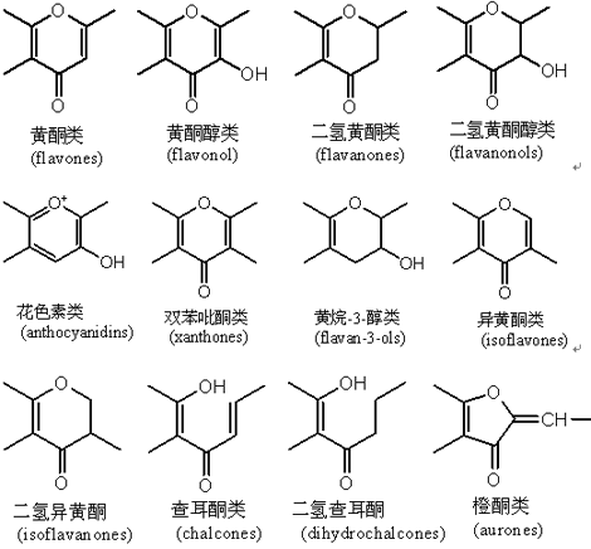
黄酮黄酮类化合物的总称黄酮(flavone),是黄酮类化合物的总称,泛指两个具有酚羟基的苯环(A-与B-环)通过中央三碳原子相互连结而成的一系列化合物。黄酮类化合物结构中常连接有酚羟基、甲氧基、甲基、异戊烯基等官能团。黄酮类化合物(英语:Flavonoid,又称类黄酮)是指基本母核为2-苯基色原酮类化合物,现在则泛指两个具有酚羟基的苯环通过中央三碳原子相互连接的一系列化合物。他们来自于水果、蔬菜、
郭靖,四川高桥土豪巡检。公元1207年,因南宋四川主将吴曦叛宋降金,四川百姓不愿受叛徒和金国的奴役,于是顺嘉陵江逃亡,遭吴曦派兵追赶,郭靖不愿沦为敌国臣民,于是向弟弟表明爱国情怀后投江而死,这就是历史上真实的郭靖,也是金庸武侠小说《射雕英雄传》、《神雕侠侣》的重要角色郭靖的姓名来源。另外南宋镇守襄阳的大将吕文德、吕文焕,救援襄阳的义军首领张顺、张贵,蒙古将领郭侃都是金庸创作郭靖的原型素材,例如郭靖在蒙古那段金刀驸马的经历,基本上跟郭侃是重合的。他们的经历与郭靖名字形成了小说中的郭靖形象。

尚可名片
这家伙太懒了,什么都没写!