病原学
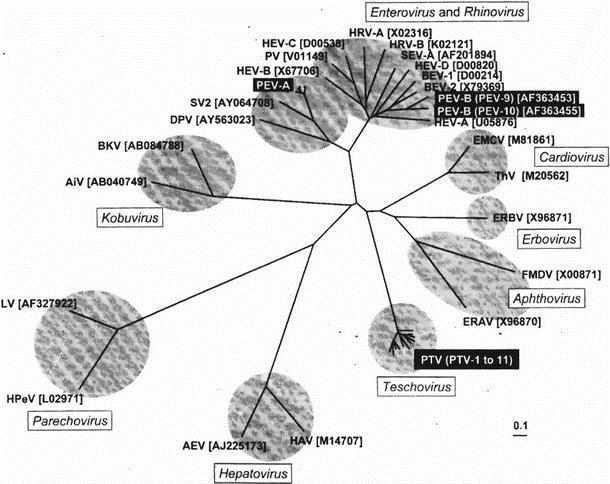
猪肠病毒和猪肠道病毒的血清学分类是基于病毒中和(VN)试验(Dunne 等,1971;Knowles 等,1979)。在二十世纪六、七十年代,人们做了大量的尝试以期获得一种统一的分类方法。这些研究成果最终归结成为由Dunne等人(1971)所共同提议的八种血清型的分类方式,此种分类方式的血清型最终扩展到目前的13种(Auerbach 等,1994;Knowles 等,1979)(表18.1)。适用于对猪肠道病毒进行快速筛选和分型的补体结合试验也已有报道(Knowles 和 Buckley,1980)。后来的研究(Knowles,1983)指出,还可能存在其他未发现的血清型。Honda等(1990)借助补体结合试验对来自日本的典型株和11株来自世界各地的不同PTV和PEV血清型进行了比较研究,结果显示存在另外四种候选血清型。有限的血清学交叉反应很明显的存在于已发现的血清型之中,Hazlett和Derbyshire(1978)的研究显示胃肠抗体比血清抗体具有更广泛的特异性。
当前,人们已经确定了PEV所有血清型标准毒株的基因组序列,而且也得到了大量的其他分离株的部分基因组序列(Doherty等,1999;Kaku等,1999, 2001;Krumbholz等,2002; Peng,Lin, Kitching和Knowles 1998, GenBank登录号AJ001391;Peng,McCauley,Kitching和Knowles 1997,GenBank登录号Y14459; Zell等 2001)。对所得结果比较分析可以看出,PEV-1~7型和11~13型的基因组与PEV-8~10型以及人和牛肠道病毒不同。它们都具有前导肽和一个2A/2B裂解机制,这与口蹄疫病毒属、心病毒属和艾波病毒相似。因此,这10种血清型被重新命名为PTV-1~10型,并单独作为一个物种进行重分类,称为猪肠病毒,属于一个新的肠病毒属。此外,根据已知的血清学和基因序列数据,猪肠病毒的另一个血清型PTV-11也被划归为肠病毒属(Zell等,2001)。
形态学
与所有小核糖核酸病毒相似,PTV和PEV病毒粒子都为球形,无囊膜,直径约25~30nm左右。病毒的单链核糖核酸被四种多肽链的60个拷贝构成的二十面体衣壳所包围,一个小的基本病毒编码蛋白(VPg)与基因组的5’端相连。目前为止,还没有该病毒的三维结构数据可以应用。
流行病学
毒力较强的PTV-1毒株与经典的捷申病相关,疾病仅在发生过该病的地区出现,而且目前为止,还没有在北美洲分离到该毒株。毒力较弱的PTV-1株和其它血清型的典型株分布较广,PEV-8株也是如此(Odend’hal,1983)。然而,PEV-9和PEV-10只有在意大利、英国和日本的存在得到确认(Caracappa等,1985;Honda等,1990;Knowles等,1979;Zoletto,1965)。
目前已知,猪肠病毒和猪肠道病毒的自然宿主只有猪。试验发现,妊娠的几内亚猪感染了PEV-8株导致了胎盘损害(Lieu,1976)。
PEV和PTV感染的传播主要是通过粪便-口腔途径,也可经由其它污染物进行间接传播,因为病毒有相对较强的抵抗力。
PTV的几个血清型和PEV-8的地方性流行感染通常发生在普通猪群,也可见于断奶仔猪群。Singh和Bohl(1972)通过对单个猪群26个月的长期研究,证明了病毒六个血清型呈波浪式感染。当仔猪断奶后不久,母源抗体消退后和不同窝的仔猪混养时,病毒感染常常发生,并且感染至少能持续几周。成年动物很少排泄病毒,但机体具有很高的血清抗体水平。不论任何日龄的猪,它们对没有接触过的任何一种病毒血清型都很敏感。
猪肠道病毒和猪肠病毒有很强的环境抵抗能力,捷申病毒可以在十五摄氏度下存活168天之久(Ottis,1976)。这些病毒也可以在液体粪尿中存在很长的时间,但如果粪尿充分暴露在空气中,病毒将很快失活(Lund和Nissen,1983)。同样,粪尿如果经过电离辐射(Simon等,1983)或者无氧发酵(Derbyshire等,1986),病毒也将失活。
发病机理
自然感染病例通常都是通过食入病毒引起,现有的研究已经确认病毒最初的复制是在扁桃体和肠道(Long,1985)。研究发现,大肠和回肠要比消化道前部的小肠受感染频率高,而且组织含有较高的病毒滴度。目前为止,还不能确定肠道内何种细胞支持病毒的复制,但通过对脊髓灰质炎病毒的试验分析认为(Kanamitsu等,1967),可能是肠固有层内网状内皮组织的作用,但上皮细胞破坏不是这些感染的特征。在强毒株PTV-1感染后,常出现病毒血症,但弱毒株感染很少出现病毒血症,可以导致中枢神经系统感染(CNS)(Holman等,1966)。病毒血症的散播可能引起怀孕猪子宫感染,通过对小母猪进行口鼻接种PEV-8和PTV,结果发现可以引起胚胎和胎儿的感染(Huang等,1980)。
病毒鼻内接种试验可能引起肺脏感染(Meyer等,1966),但是目前还不清楚病毒气雾自然吸入的重要性。现已证明,当小猪经过非肠道途径感染猪肠病毒后,病毒可以很快的感染肠道。病毒肠外感染是暂时性的,但可以在大肠内存留数周。
临床表现
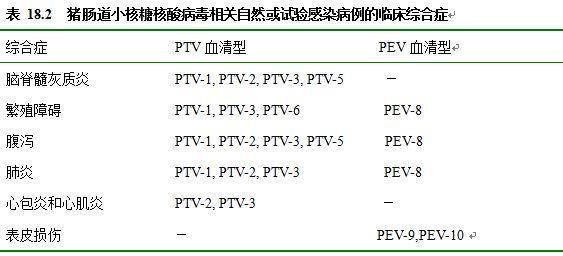
尽管猪肠道病毒和猪肠病毒常见亚临床感染,但针对特定的血清型也有各种临床症状,在表18.2和下面的内容中将有介绍。
猪肠道病毒
脑脊髓灰质炎最严重的脑脊髓灰质炎是由强毒株PTV-1引起的,即引起捷申病的毒株,捷申病是一种高致病率和高死亡率的疾病,它感染所有日龄的猪,已造成了巨大的经济损失。捷申病在发病初期表现为发热,厌食,精神不振,然后动物迅速出现共济失调。在严重病例中,可能出现眼球震颤、抽搐,角弓反张和昏迷。动物接着会出现麻痹,呈类似犬坐的姿势或者保持侧躺姿势。如果发病动物受到声音或者触摸等刺激,可能出现四肢运动不协调或者角弓反张。病畜通常在临床症状出现后3~4天内出现死亡。如果动物急性发病后食欲恢复,一些病猪可以在精心照料下得以恢复,但这些病例常出现肌肉萎缩或者后遗性瘫痪。
与脑脊髓灰质炎血清学相关的弱毒株PTV-1(泰法病,良性地方性动物局部麻痹)和其它毒株可以引起一种低发病率和低死亡率的温和性疾病。本病主要影响小猪,而且很少发展到完全瘫痪。
最近,由肠病毒感染引起的脑脊髓炎在美国(Pogranichniy等,2003)和日本(Yamada等,2004)的猪群中都已有相关报道。到现在为止,在猪肠道病毒感染中还没有发现神经性疾病存在。
生殖障碍
术语SEMDI最初是用来命名一组分离于死胎(S),木乃伊死胎(M),胚胎死亡(ED)和不育(I)症的病毒(Dunne等,1965),随后证明它们是猪肠道病毒或猪肠病毒。随后,由同一研究组的工作人员和他人(De Meurichy等,1976)的研究显示这些综合症状可以通过试验复制。
然而,细小病毒感染也可能导致胚胎死亡和胎儿木乃伊化,这些病毒与妊娠初期和中期的繁殖障碍的关系更加密切。其它的相关研究(Cropper等,1976)证实了猪肠病毒和猪细小病毒在这些病症中的作用,而且试验(Bielanski和Raeside,1977)和田间数据(Kirkbride和McAdaragh,1978)确认了猪肠病毒感染和猪流产之间的联系。对母猪和后备母猪来说,这些繁殖障碍并不常伴随临床症状出现。脑心肌炎病毒(小核糖核酸病毒科,心病毒属)感染也可能导致雌性动物繁殖障碍。
猪肠病毒也可以从雄性动物的生殖道内分离道(Philips等,1972),用受到污染的精液进行人工授精时并不影响小母猪的生育能力(De Meurichy和Pensaert,1977)。
腹泻
尽管人们已经从具有腹泻症状猪的粪便中分离到病毒,但猪肠道病毒和猪肠病毒作为肠道病原的地位还不确定,在正常猪体内,特别是断奶后的猪中也可以分离到该类病毒,考虑到引起腹泻的病毒性和细菌性因素很多,所以两种病毒的存在也可能是巧合。但是,用不含有其它病原的猪肠病毒感染试验猪引起了猪的腹泻,这种腹泻比较温和而且稍纵即逝,试验可以清楚的表明,猪肠病毒作为猪肠道病原的重要性远不如轮状病毒和冠状病毒。当小猪受到猪肠病毒和轮状病毒的混合感染时,其严重程度要小于单独的轮状病毒感染(Janke,1988)。有关PEV-8和腹泻的联系也有所证实,这主要是通过对表现有腹泻症状的猪进行的病毒分离所得率而研究的(Honda等,1990)。相反,从猪粪便中对PEV-9/PEV-10的分离所得率却显示两种病毒与胃肠道疾病无关(Knowles,1988)。
肺炎、心包炎和心肌炎
肠道病毒和肠病毒对呼吸系统的致病作用现在也不明确,这可能是因为单纯病毒很少引起呼吸性疾病的临床症状,但Pospisil等(1971)称小猪暴露在含猪肠病毒空气悬浮颗粒中可以使猪的呼吸增加,出现咳嗽,打喷嚏,食欲降低和精神沉郁。尽管一些研究显示病毒在某种程度上趋向于感染肺脏,但产生的肺炎变化往往是亚临床表现。有试验表明,猪肠病毒有两种血清型可以引起心包炎,而且在一个试验中出现了心肌的病变(Long等,1969)。这些发现可以使人们怀疑是肠病毒感染引起小猪的突然死亡,尽管脑心肌炎病毒是更可能的病原。
与表皮损伤的可能联系
在英国进行猪水疱病暴发的调查时发现,人们从上皮组织和粪尿中分离到很多偶发性病原。大多数分离到的病原被确定为肠病毒或者肠道病毒(Knowles,1983)。猪肠病毒和PEV-8均分布于粪便样品(分别为41%和44%)和上皮样品(分别为21%)。然而,PEV-9/PEV-10在粪中很少见(15%),但在上皮中却很常见(58%)(Knowles,1988)。在另一个病毒收集检测过程中,同样揭示了PTV和PEV-8大约相同的分布情况(分别为57%和43%),但是PEV-9和PEV-10没有被确认(Knowles,1988)。根据推测,大多数从上皮样品分离出的PTV和PEV-8是偶然的污染物,然而粪中PEV-9和PEV-10的低水平分离率不能解释从非典型的皮肤损伤中所得的病毒高分离率,所有这些联系还需要进一步的解释。
病理变化
肠道病毒和肠病毒感染一般不引起特征的病变,它们并不引起肠道绒毛萎缩,这主要是冠状病毒或轮状病毒的特征性病变。除了慢性病例中的肌肉萎缩,在脑脊髓灰质炎中未发现眼观病变。后者的组织病变广泛分布于中枢神经系统,尤其是在脊索的腹侧脊柱,小脑皮质和脑干。这些损伤在捷申病中比在温和型的脑脊髓炎(如泰法病)会更加明显和广泛。神经元(特别是小脑部位)出现渐进性的尼氏小体溶解(Koestner等1966),局部区域出现神经胶质细胞结节和血管淋巴细胞套。
在SMEDI综合症中出现死胎和新生仔猪很明显缺乏特征性的病变,尽管中度的胶质细胞增生和血管套在脑干部位偶尔可以看到。胎盘的变化仅限于非特征性病变。
许多调查研究发现,病毒感染可以造成肺部病变。Smith等(1973)报道称,动物受到PTV-2感染后肺前叶腹侧出现灰红色实变区域。在肺泡和支气管内出现渗出物,在血管周围和支气管周围炎性细胞轻微的套状浸润,细支气管上皮细胞异常增生。
PTV-3株在动物试验中常引起浆液性心包炎,感染较严重的小猪甚至出现局灶性心肌坏死(Long等,1969)。
预防和控制
像大多数病毒感染一样,猪肠道病毒的防制方法也是预防的意义大于治疗。尚未有有效防治猪肠道小核糖核酸病毒的化学疗法。患有轻度脑脊髓灰质炎病毒的动物在它们短暂麻痹期间,如果受到精心照料,有可能康复。
在疫苗接种免疫上,只有在对捷申病防控上进行过实践。最初的捷申病疫苗,包括猪组织源性灭活病毒,现已被致弱的或灭活了的细胞培养病毒疫苗所替代。Mayr和Correns(1959)通过细胞培养途经致弱捷申病病毒,发现活病毒和福尔马林灭活的病毒在仔猪身上引起相似的保护水平。有关捷申病病毒彻底清除的成功程序包括集体免疫和屠杀(Schaupp,1968)。限制从疾病流行地区进口猪只和猪肉制品,可以有效的控制PTV-1株的传播,这些毒株如果传到北美,他们会根据检疫和屠杀政策进行防控。
还没有疫苗接种的方法用来防制温和型的猪脑脊髓灰质炎和PTV和PEV的其它临床感染类型。只有SEMDI综合征有足够的经济重要性以寻求田间的特异性防制,但众多的血清型可能使有效疫苗的研制变得复杂。
当前,防制猪肠病毒和猪肠道病毒有关的繁殖障碍,最有效的方法是确保后备母猪至少繁殖前1个月让其感染当前流行的猪肠道病毒和猪肠病毒,这可以利用后备母猪自出生到配种期间与不同来源的断奶小猪在同一舍混养而自然实现。如果饲养的猪在较早日龄时已经分开,它们应与最近断奶猪粪便相接触。这可以通过在后备母猪的饲料中添加新鲜粪便或者给后备母猪饲喂含有粪便的胶囊,这些粪便应该是几个猪圈的猪粪混合物,而且混合的越多越好。
封闭式管理的操作方法可降低动物受外部病毒感染的风险,但也不可能彻底的消除病毒传入的危险,因为抵抗力比较强的肠道小核糖核酸病毒可以借助多种污染物传播。如果新引进的动物是用作繁殖目的,在配种前很有必要接触场内已存在或者可能引入的病毒(通过如上所述的粪便污染物)。
在一段时间内,通过无特定病原(SPF)猪进行繁衍猪群以排除猪肠道病毒和猪肠病毒似乎很难或者不可能维持很长时间,有学者已经从商品SPF猪群中分离到这些病毒(Derbyshire等,1966),而且有报道称,在严格隔离的条件下饲养SPF小母猪,也存在偶然感染泰法病病毒的情况(Parker等,1981)。考虑到胎儿可以经胎盘感染,因此无菌猪也已有可能被感染。