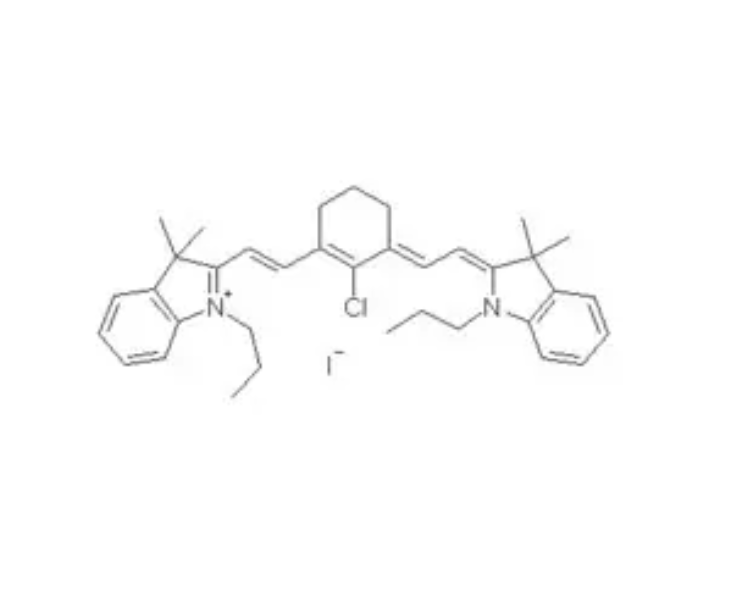
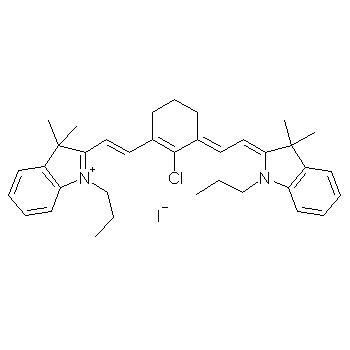
碘化物是含碘为-1价的化合物,包括金属碘化物和非金属碘化物。活泼金属的碘化物是离子化合物,其他金属化合物及非金属化合物都是共价化合物。大多数碘化物易溶于水,但碘化银、碘化亚汞、碘化汞、碘化亚铜、碘化铅难溶。有机碘化物一般比相应的氯化物或溴化物活泼。烷基碘可用于烷基化反应。在酸性溶液中碘离子容易被空气中的氧氧化成单质碘分子。在碱性溶液内,碘化物则不易被氧化。
精选百科
本文由作者推荐
碘化物相关的文章
矢泽爱(日文:矢沢 あい),日本漫画家、插画家,1967年3月7日出生于日本兵库县。主要作品有《一起去吹吹风》《天堂之吻》《娜娜》《近所物语》《圣学园天使》等。
甜瓜(学名:Cucumis melo L.)是葫芦科(Cucurbitaceae)黄瓜属(Cucumis)植物,别名白兰瓜、哈密瓜、香瓜。甜瓜原产于印度和非洲国家,后广泛引种于世界温带至热带地区,中国各地广泛栽培。甜瓜喜光照,喜温耐热,常生长在土层深厚、通透性好、不易积水的沙土中。
章和是东汉章帝刘炟的第三个年号,也是他的最后一个年号,共计18个月。该年号在历史上被用作几个政权的年号。据《资治通鉴》记载,元和四年七月廿七壬戌(87年9月12日),章和正式改元。在章和二年二月,汉和帝即位时沿用该年号,但次年正月初一(89年1月30日)改元永元。
星新一少年科幻安徽少年儿童出版社出版的图书《星新一少年科幻》是日本科幻之父星新一的科幻短篇精选集,各分册是《情感电视机》《梦之城》《妄想银行》《淘气的机器人》《你好,地球人》,除了收录作者各个时期的代表作品,还收录了入选语文教材和课外阅读的篇目。
李治本词条是多义词,共15个义项唐朝第三位皇帝唐高宗李治(628年7月21日 -683年12月27日),字为善,唐朝第三位皇帝(649年7月15日-683年12月27日在位),唐太宗李世民第九子,母为文德顺圣皇后长孙氏,皇太子李承乾、魏王李泰同母弟。贞观二年(628年)六月,李治出生于东宫丽正殿。贞观五年(631年)封晋王,后皇太子李承乾与次子魏王李泰相继被废,于贞观十七年(643年)被册为皇太子

尚可名片
这家伙太懒了,什么都没写!
作者