简介
二醇
用数字标明羟基的相对位置。对于简单的或泛指的二醇,羟基的相对位置可用希腊字母
分别表示相邻、相隔一个和两个碳……;
表示两个羟基分别位于分子的两端。一般分脂肪二醇、环二醇和苯基取代的脂肪二醇三大类,各类又可按羟基的相对位置再分类。性质
链状脂肪二醇从含6个碳原子开始皆为固体,不足6个碳原子的二醇为粘稠液体。环二醇,如环戊或环己二醇也都是固体。苯基取代的脂肪二醇中,其中一个羟基位于α碳上则容易形成固体;两个羟基都距芳基较远时,则往往难成为固体。最简单的二醇,如乙二醇、丙二醇可在常压下蒸馏,其他的低级二醇须减压蒸馏,否则容易失水。通常每增加一个碳原子,沸点约升高10~15℃,但

二醇沸点相差
。一般两个羟基相距越远,沸点越高(氢键的影响)。例如 
二醇的沸点比其相应的同分异构体高
。但羟基位于三级碳上的二醇比相应的其他二醇的沸点低。制法
方法很多,主要包括:二卤代烃、卤代醇、环氧化合物的直接或间接水解;二元醛、酮、酸及羰基酸的氢化;羟基醛、酮、酸、环氧化合物的还原;二烯的水合;烯烃的氧化等。这些方法制得的二醇产物与原料的碳原子数相同。用格利雅试剂与二元醛、酮或酯反应,则可得到比原料碳原子数多的二醇,并能制得环二醇。用羟醛缩合(见缩合反应),也可得到碳原子数增多的产物。
化学反应
氧化邻二醇高碘酸
高碘酸(

)、偏高碘酸钾(
)、偏高碘酸钠(
)的水溶液可以使1,2-二醇的碳碳键断裂,羟基氧化成相应的醛、酮,并且能够定量的反应。因此根据高碘酸的消耗量可以推知多元醇中所含相邻醇羟基的数目。反应过程中生成了环状酯中间体。多元醇如果其羟基均处于相邻的位置,在与一分子高碘酸反应后得到α-羟基醛或酮,可进一步与高碘酸反应,其过程和1,2-二醇类似,形成环状酯中间体。对于多羟基化合物的氧化产物,可简单看做是醇羟基所连接的碳原子之间的碳断裂,断裂部分各与一个羟基结合,然后失水,这样可以方便的推出最终的氧化产物。另一方面,也可以根据
消耗数量及氧化产物来推测原化合物的结构。四醋酸铅
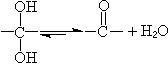
1,2-二醇可以被四醋酸铅

氧化,通常在醋酸或苯溶液中进行,反应是定量的,因此也用于1,2-二醇的定量分析。但此试剂能与其他含羟基的分子反应,因此不能用水或醇作溶剂,但少量水,特别是醋酸,对氧化反应并无大碍。1,2-二醇可以被四醋酸铅氧化的过程与被高碘酸氧化的过程一样,其氧化过程也是经过了环状酯中间体。顺型的1,2-二醇比反型的相对速率大得多,这与形成环状酯中间体有关,反型的环状酯因五元环的扭曲而不易形成,但如果用吡啶作反应溶剂,会加快反-1,2-二醇的反应速率。
频那醇重排这类反应最初是从频那酮发现的,因此这类重排称为频那酮重排,α-双二级醇、α-二级醇三级醇、α-双三级醇均能发生这类重排。这类重排发生的机理,首先在酸的作用下发生羟基质子化形成(i),(i)失水形成碳正离子(ii),相继发生基团的迁移,缺电子重心转移到羟基的氧原子上(iii),(ii)中带正电荷的碳为6电子,(iii)中氧盐中的氧为8电子,所以(iii)比(ii)稳定,这是促使重排发生的原因,(iii)失去质子生成频那酮。不对称的乙二醇中,一般能形成比较稳定的碳正离子的碳上的羟基易被质子化。
知识拓展
醇,是指羟基与一个脂肪族烃基相连而成的化合物;羟基与苯环相连,则由于化学性质与普通的醇有所不同而分类为酚;羟基与

.杂化的双键碳原子相连,属烯醇类,该类化合物由于会互变异构为酮,因此大多无法稳定存在。一、醇的分类、结构和物理性质
1、醇的分类
根据羟基所连接的碳原子的级分类,羟基连在一级碳原子上的醇称为一级醇,也称为伯醇;羟基连在二级碳原子上的醇称为二级醇,也称为仲醇;羟基连在三级碳原子上的醇称为三级醇,也称为叔醇。羟基与不饱和碳原子相连的醇很不稳定,称为烯醇,它很快会异构化为醛、酮。
2、醇的熔点和沸点
低级醇的熔点和沸点比碳原子数相同的碳氢化合物的熔点和沸点高得多,这是因为醇分子间有氢键缔合作用。醇在固态时,缔合较为牢固,液态时,氢键断开后,还会再形成,但在气相或非极性溶剂的稀溶液中,醇分子彼此相距甚远,各个醇分子可以单独存在。分子间氢键随着浓度的升高而增加,分子内氢键却不受浓度的影响。
3、醇的结构
一般情况下,相邻的两个碳原子上最大的两个基团处于对交叉构象最稳定,是优势构象,担当这两个基团可能以氢键缔合时,由于形成氢键可以增加分子的稳定性。两个分子处于临交叉构象成为优势构象。
二、醇的酸碱性
酸醇的酸性和碱性与和氧相连的烃基的电子效应相关,烃基的吸电子能力越强,醇的碱性越弱,酸性越强。相反,烃基的给电子能力越强,醇的碱性越强,酸性越弱。烃基的空间位阻对醇的酸碱性也有影响,因此分析烃基的电子效应和空间位阻影响是十分重要的。


















